محاسبات نرمالیته
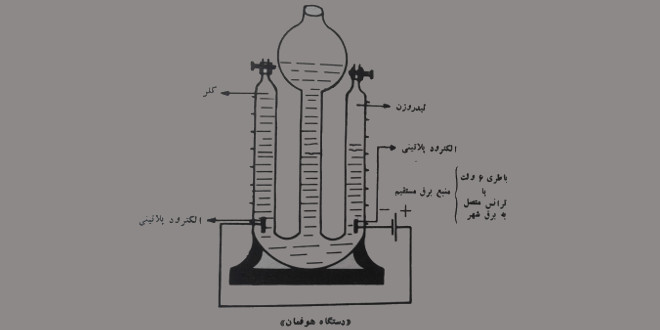
تهیه گاز کلر از الکترولیز محلول نمک طعام
اردیبهشت ۲۲, ۱۳۹۷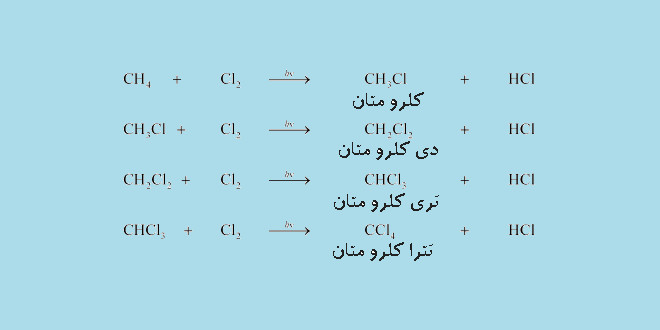
کلردار کردن متان
اردیبهشت ۲۷, ۱۳۹۷تعریف نرمالیته: تعداد اکیوالان های حل شده در یک لیتر محلول
تعریف اکی والان: تعداد گرم هایی از هر ماده که در واکنش های شیمیایی معادل یک گرم هیدروژن عمل نماید.
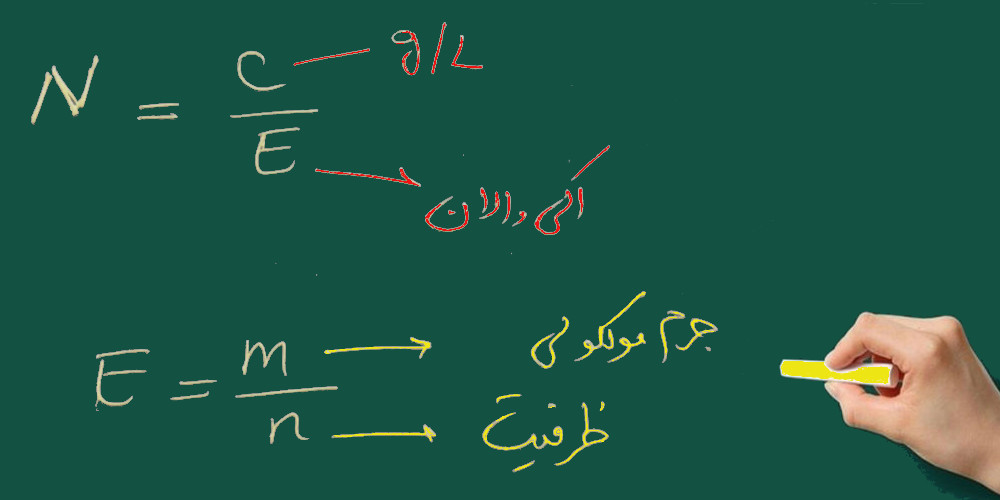
عدد n برای اسیدها برابر تعداد یون هیدروژنی است که در آب آزاد می کند. مثال:
عدد n برای بازها برابر تعداد یون هیدرواکسیدی است که در آب آزاد می کند. مثال:
عدد n برای نمک ها برابر تعداد فلز ضرب در ظرفیت فلز. مثال:
عدد n برای فلزات برابر ظرفیت فلز. مثال:
عدد n برای نافلزات برابر ظرفیت نافلز . مثال:
عدد n در واکنش های اکسایش کاهش برابر تغییر عدد اکسایش یا کاهش. مثال:
MnO4– + H+ + e– → Mn2+ + H2O
در واکنش بالا تغییر درجه ی Mn از ۷+ به ۲+ (پنج درجه) تغییر کرده پس n برابر ۵ است
دیگر فرمول های مورد استفاده در مسائل نرمالیته:
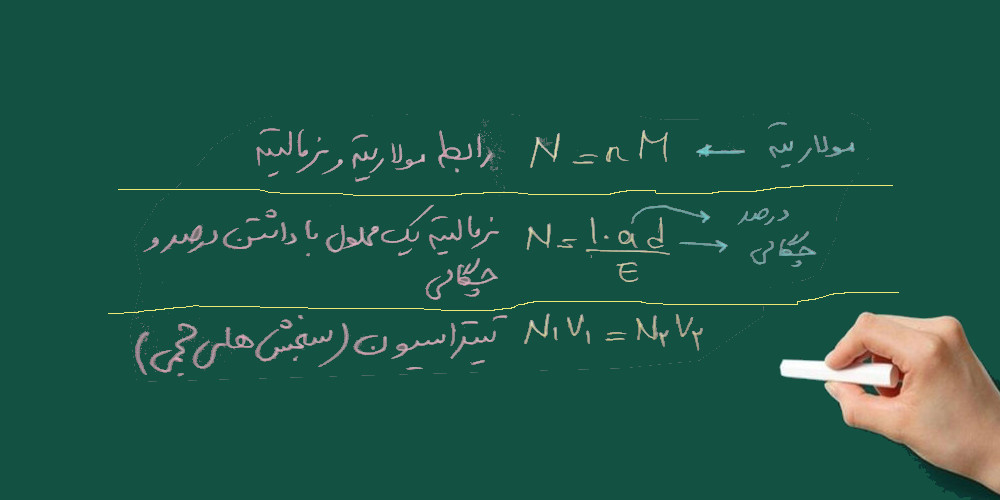
چند نمونه مسئله که با فرمول های بالا حل می شود:
۱- نرمالیته محلول ۲ گرم بر لیتر سدیم هیدرواکسید (سود سوز آور) را به دست آورید؟
NaOH=40 g/mol
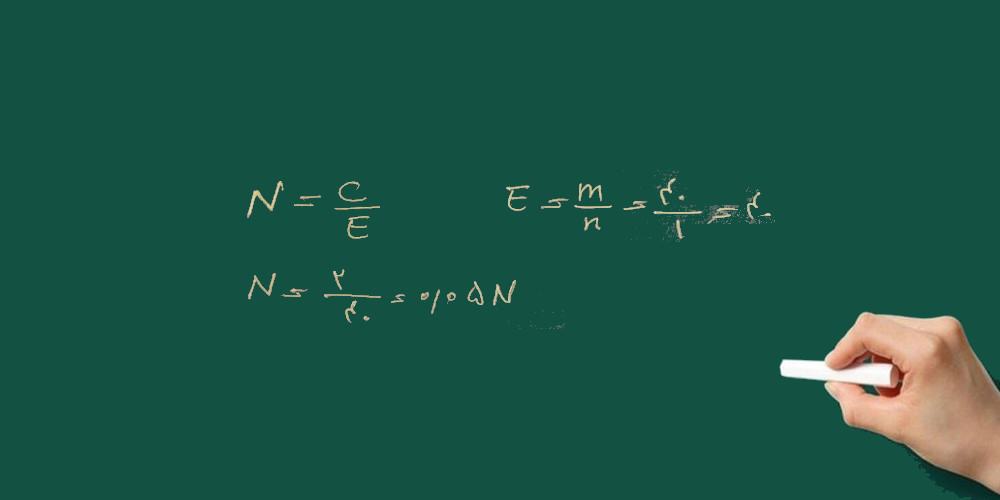
۲- نرمالیته محلول سولفوریک اسید ۹۵٪ با چگالی ۱/۸ گرم بر سانتی متر مکعب را به دست آورید؟
H2SO4=98 g/mol
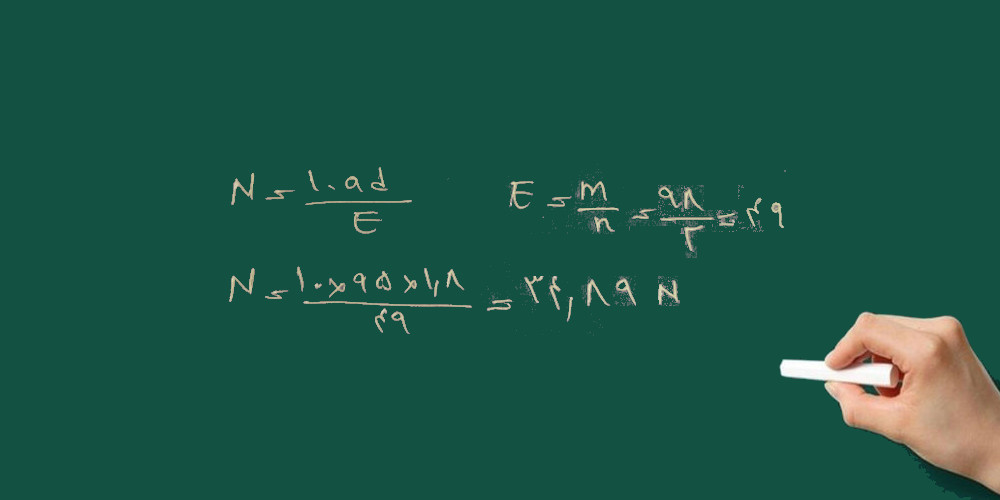
۳- برای تهیه ی ۲۵۰ سی سی محلول ۲ نرمال پتاسیم هیدرواکسید (پتاس سوز آور) چند گرم پتاس خالص را باید به حجم برسانیم؟
KOH=56 g/mol
چون پتاس سوز آور خالص(جامد خشک) است از روش زیر استفاده می کنیم. این روش برای همه ی مواد جامد به کار می رود.
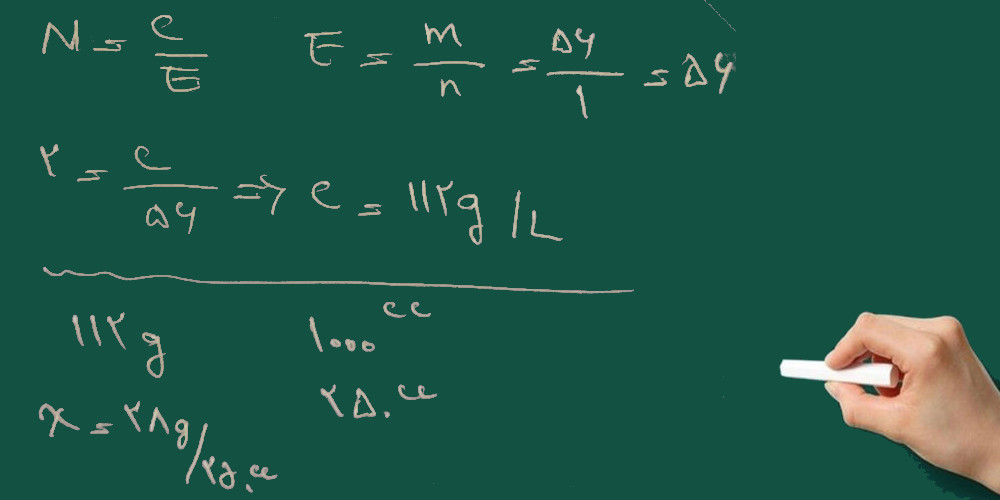
۴- برای تهیه ی ۲۵۰ سی سی محلول ۲ نرمال نیتریک اسید چند سی سی از اسید ۶۵٪ با چگالی ۱/۴ گرم بر سانتی متر مکعب را باید به حجم برسانیم؟
HNO3=63 g/mol
چون نیتریک اسید محلول است (وقتی محلول است صورت مسئله درصد و چگالی را می دهد) از روش زیر حل می کنیم.
ابتدا نرمالیته ی محلول غلیظ را به دست می آوریم:
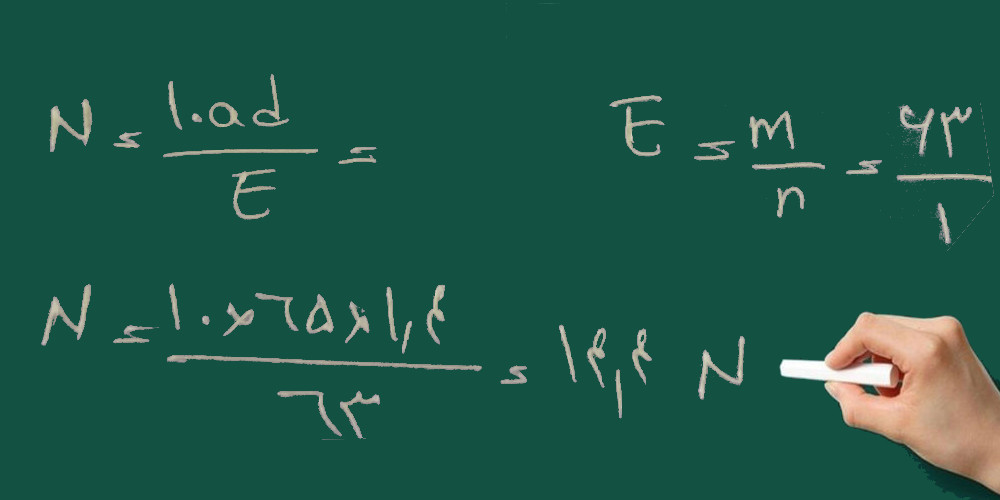 سپس با استفاده از فرمول زیر محاسبه می کنیم چند سی سی از اسید غلیظ را باید به حجم برسانیم:
سپس با استفاده از فرمول زیر محاسبه می کنیم چند سی سی از اسید غلیظ را باید به حجم برسانیم:
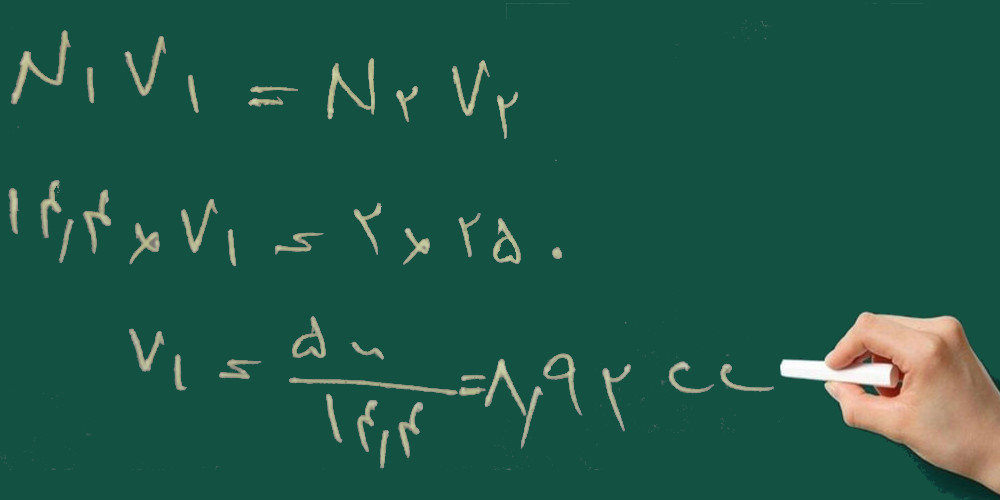
تصحیح می شود: جواب ۳۴/۷ می شود نه ۸/۹۲
یعنی ۳۴/۷ سی سی از اسید غلیظ را باید به حجم ۲۵۰ سی سی برسانیم تا محلول ۲ نرمال حاصل شود
۵- ده (۱۰) سی سی سود نرمال( یک نرمال) توسط ۲/۵ سی سی هیدروکلریک اسید(HCl) خنثی می شود نرمالیته و مولاریته اسید را به دست آورید؟
NaOH=40 g/mol
HCl=36/5 g/mol
 با توجه به فرمول N=nM برای اسیدها و بازهای یک ظرفیتی n=1 نرمالیته و مولاریته با هم برابر است.
با توجه به فرمول N=nM برای اسیدها و بازهای یک ظرفیتی n=1 نرمالیته و مولاریته با هم برابر است.
۶- هر میلی لیتر HCl ١ نرمال برابر با چند میلیگرم سدیم استات میباشد؟ وزن مولکولی سدیم استات: ٨٢.٠٣
۱- ابتدا گرم بر لیتر هیدروکلریک اسید را به دست می آوریم.
۲- با داشتن گرم بر لیتر تعداد گرم های HCl را در یک میلی لیتر به دست می آوریم.
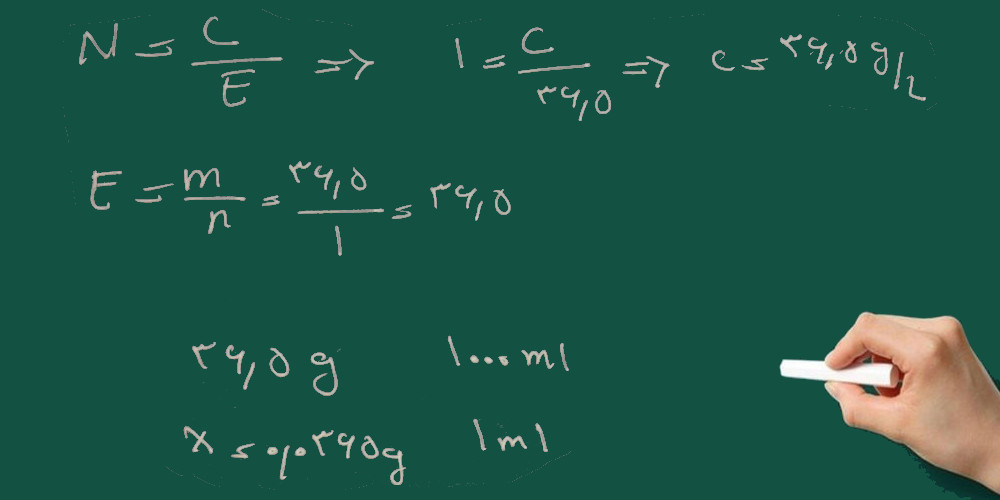
۳- بر اساس معادله واکنش یک مول سدیم استات با یک مول هیدروکلریک اسید واکنش می دهد. با استفاده از تناسب زیر ابتدا تعداد گرم سدیم استات که در واکنش شرکت می کند را به دست می آوریم و سپس گرم را به میلی گرم تبدیل می کنیم.
مطالب مرتبط با این پست:
محاسبات مولاریته
تفاوت مولاریته و مولالیته
نکات کنکوری شیمی
برای فرراگیری بهتر و عمیق تر این بخش از دانش شیمی اپلیکیشن محلول ها را بخوانید:
همچنین اپلیکیشن محاسبه گر شیمی ۲۱ نوع محاسبه ی شیمی را انجام می دهد از جمله محاسبات غلظت ها
برای سهولت در بازبینی وب سایت شیمی کیمیکال و ده ها وب سایت شیمی ایرانی و خارجی دیگر و شبکه های اجتماعی مرتبط و همچنین سهولت در به اشتراک گذاری مطالب آن ها اپلیکیشن رایگان کیمیکال پلاس را نصب کنید.






37 Comments
سلام. وقت بخیر
با تشکر از توضیحات جامع و کاملتون. اثبات رابطه N=10ad/E رو میخاستم. ممنون میشم راهنمایی بفرمایید.
سلام لطفا اثبات این رابطه رو راهنمایی بفرنایید
سلام
بسیارعالی و کامل توضیح دادید.واقعا لذت بردم.خسته نباشید.درپناه حق
kheyliiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiiii mamnoooon
تشکر
با سلام. میشه لطفا” جواب سوال زیر را پاسخ دهید؟
هر میلی لیتر پرکلریک اسید ۰.۱ نرمال معادل چند میلی گرم گاباپنتین هست؟ وزن مولکولی پرکلریک اسید: ۱۰۰.۴۶ g/mol
وزن مولکولی گاباپنتین:۱۷۱.۲۳۷ (C9H17NO2)
با سپاس فراوان
معادل ۱۷.۱۲۴ میلی گرم گاباپنتین است
سلام
یه سوال داشتم براى درست کردن ده سى سى TE اینارو چقد باید بریزم و همینطور اب مقطر
١٠ میلى مول تریس + یک میلى مول EDTa
متشکرم
thanks
بسیار عالی بود توضیحات.
روش تصحیح نرمالیته را میخواستم
خیلی ممنون. عالی بود
کلا همه چی عالی بود مولاریته نرمالیته مولالیته حرف ندارین
عالی بودممنونم
سلام Hcl 0.4N را بخواهم به ۲۵۰mlمحلول NaOH,0/5Mاضافه کنم چه مقدار میشود؟
سلام.اگر بخوایم ۲۵میلی لیتر hclنرمال۵ از hcl غلیظ بسازیم محاسبات آن چطوریه؟
و همین مقدار را ازhcl50%بسازیم محاسباتش چطوریه؟
خیلی توضیحاتتون خوب و کامل بود ممنون ?
سلام. ممنون از توضیحات بسیار کامل و جامعتون. فقط در مثال ۴ چطور ۵۰۰ تقسیم بر ۱۴.۴ شده ۸.۹۲؟؟؟?
درست می فرمایید …اشتباه شده
بسیار عالی
خود راه حل درسته؟ چون اسید دوم رونگفته اصلا چی هست که ما ظرفیتش رو بدونیم پس از طریق m1v1=m2v2 بهتر نیست حل کنیم؟ و اینکه اسید نیتریک ۲مولار در ۲۵۰سی سی یعنی ۰.۵مولار
بسیار عالی وساده خداقوت
ممنون
اقا واقعا دستتون درد نکنه خیلی مفید بود
سلام ممنون از مطالب مفیدتون میشه این مسئله رو حل کنین
غلظت محلولی به غلظت نرمالیته ٠/۴ با حجم ٢۵٠ cc چند گرم NAOH دارد؟و حجم H2O چقدر است؟خسته تباشین ممنون
درود بر شما
مسئله های مشابه حل شده…دقت کنید لطفآ
سلام
ممنون از ارائه ی مطالب مفبد و آموزنده در سایت
میخواستم طرز تهیه محلول ۰.۲ نرمال از سدیم تیوسولفات (Na2S2O3) در حجم یک لیتر رو بدونم
ممنون میشم راهنمایی کنید
باتشکر
ممنون.بسیار عالی
سلام وقت بخیر. من ی تیترازول هیدروکلریک اسید یک دهم نرمال دارم ک به حجم ۱ لیتر رسوندمش الان بعد از چندماه میخوام استفادش کنم ب نرمالیتش شک دارم ک تغییر کرده یا ن. چطور نرمالیتش رو بفهمم؟
هیچ وقت جایی نظر نمیدادم اما امشب خیلی لطف بزرگی بهم کردید و انصاف نبود تشکر نکنم
واقغا ممنونم ازتون و امیدوارم خدا براتون بهترینا رو بخواد.
۲۵۰ میلی گرم تری کلرواستیک اسید در حجم ۵۰ میلی لیتر محلول داریم. فرمالیته و مولاریته آن را برای اجزای اسید به دست آورید . اسید ۶۵ درصد در آب یونیزه میشود.cl3cooh=163/4
با تشکر
محتوای سایت و طراحی خلاقانه آن بسیار عالی و زیباست.
ندیدم سایت به این خوبی بعد هفت سال شیمی خوندن
تعداد اکی والان های موجود ۲گرم سود در ۱۰۰میلی لیتر محلول چقدر می شود ممنون میشم جواب بدین
درود بر شما
هر چها گرم سود یک اکیوالان است پس ۲ گرم برابر پنج صدم اگی والات می شود
سلام.در تهیه محلول سدیم تیوسولفات اگر واکنش رسوبی باشد عدد اکی والان ۲ و اگر اکسایش کاهش باشد ۱ میشود. در اینصورت تهیه محلول با نرمالیته مشخص درست هست؟
مثلا در واکنش با ید ۱ و در واکنش با نقره ۲ هست.
نجاتم دادی. خیلییی ممنونم
با سلام در مورد تهیه EDTA 0.01 نرمال با حل فرمول توضیح میدین!؟!