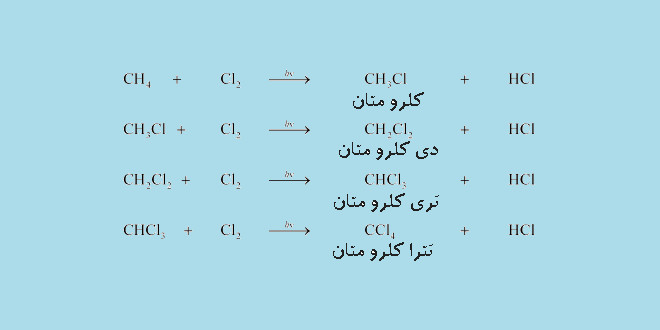
کلردار کردن متان

محاسبات نرمالیته
اردیبهشت ۲۴, ۱۳۹۷
نکاتی در مورد تعیین عدد اکسایش
اردیبهشت ۳۱, ۱۳۹۷حل یک تست شیمی آلی سال های گذشته:
اسید حاصل از کلر دار شدن ۸ گرم متان، با ۸۰ گرم سدیم هیدرواکسید خنثی می شود. اگر بازده عمل ۱۰۰٪ باشد و فرض شود فقط یک ماده ی آلی تشکیل شده است، فرمول مولکولی این ماده آلی کدام است؟
Na=23g/mol , O=16g/mol , H=1g/mol , C=12g/mol
1) CCl4
2) CH3Cl
3) CH2Cl2
4) CHCl3
کلردار کردن متان یک واکنش جانشینی رادیکالی است که در باره ی آن و مکانیسم کلر دار شدن در اپلیکیشن شیمی آلی آموزش های لازم را داده ایم.
در کلر دار کردن متان ممکن است یک تا چهار مول کلر در واکنش با هر مول متان شرکت کند بنابر این یکی از واکنش های زیر ممکن است روی دهد:
CH4 + Cl2 → CH3Cl + HCl
CH4 + 2Cl2 → CH2Cl2 + 2HCl
CH4 + 3Cl2 → CHCl3 + 3HCl
CH4 + 4Cl2 → CCl4 + 4HCl
خوب ما نمی دانیم کدامیک از واکنش های بالا صورت گرفته است. صورت مسئله می گوید ۸ گرم متان با ۸۰ گرم سدیم هیدرواکسید واکنش می دهد پس باید واکنش آن دو را هم بدانیم.
می دانیم اسید با باز نمک و آب می دهد ( برای آشنایی بیشتر با این نوع واکنش ها اپلیکیشن معادله واکنش بساز و موازنه کن را بخوانید و تمرین های آن را انجام دهید) پس باید واکنش موازنه شده آن را نیز بنویسیم
HCl + NaOH → NaCl + H2O
همان طور کی می بینید نسبت هیدروژن کلرید به سدیم هیدرواکسید ۱ به ۱ است. بنابر این می توانیم برای واکنش های بالا تناسب زیر را بنویسیم:
پس هر مول اسید تولید شده در واکنش کلر دار کردن با یک مول سود سوز آور(سدیم هیدرواکسید) واکنش می دهد
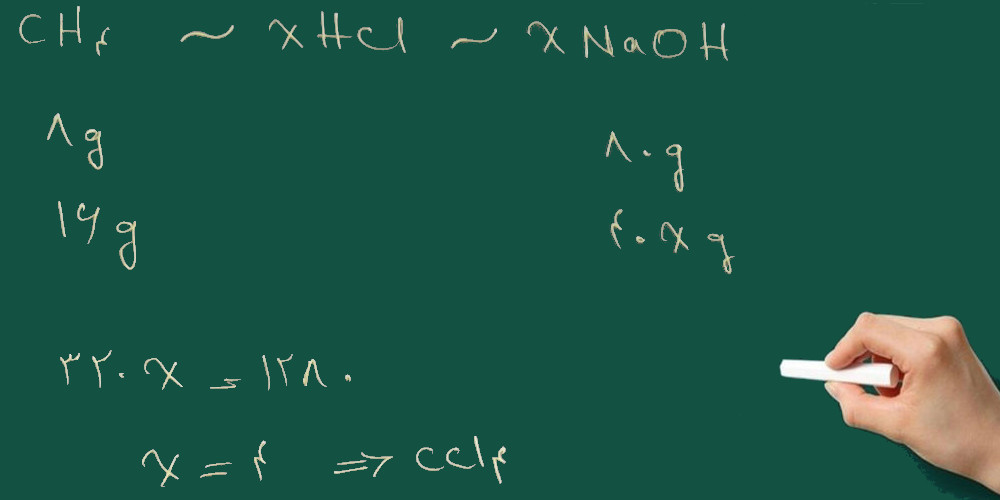
با توجه به تناسب بالا گزینه ی ۱ درست است
دیگر نکات کنکوری شیمی
اپلیکیشن های مرتبط با این درس:
اپلیکیشن شیمی آلی

اپلیکیشن معادله واکنش بساز و موازنه کن