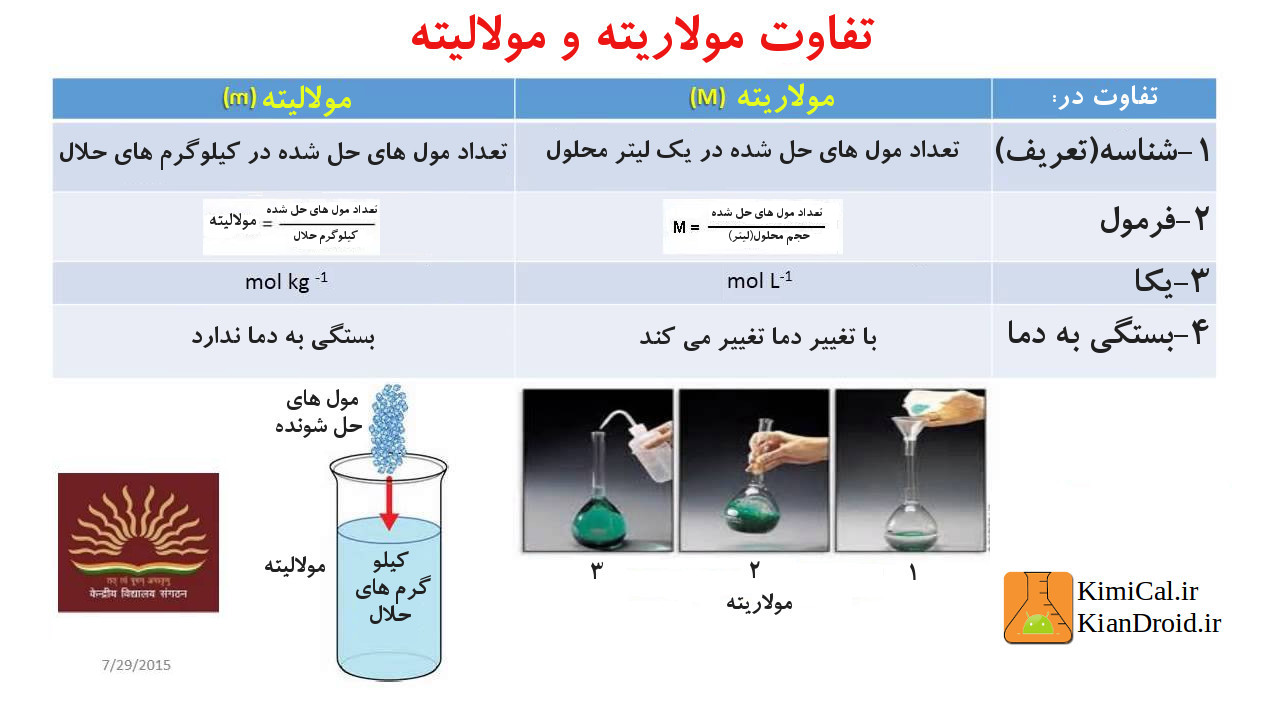
تفاوت بین مولاریته و مولالیته

محاسبات مولاریته
آذر ۳۰, ۱۳۹۶
حقایق شیمی(عناصر)
دی ۷, ۱۳۹۶ابتدا هر دو واژه را تعریف کنیم:
مولاریته: تعداد مول های حل شده در یک لیتر محلول
مولالیته: تعداد مول های حل شده در کیلوگرم های حلال
به دو واژه ی محلول(در مولاریته) و حلال(در مولالیته) دقت کنید.
اکنون با یک مثال تفاوت این دو را نشان می دهیم:
اطلاعات لازم: جرم مولی سدیم هیدرو اکسید
NaOH=40g/mol
*یک لیتر محلول ۱ مولار سدیم هیدرواکسید(سود سوز آور) تهیه کنید.
۱- ابتدا یک بالن ژوژه (حجمی) یک لیتری بر می داریم.
۲- آن را تا نیمه با آب مقطر پر می کنیم.
۳- چهل گرم(یک مول) سدیم هیدرواکسید را به آن اضافه می کنیم و به هم می زنیم تا کاملآ حل شود.
۴- سپس با آب مقطر آن را به حجم یک لیتر می رسانیم
**یک لیتر محلول ۱ مولال سدیم هیدرواکسید(سود سوز آور) تهیه کنید.
۱- ابتدا یک بالن ژوژه (حجمی) یک لیتری بر می داریم.
۲- آن را تا خط نشانه یک لیتر با آب مقطر پر می کنیم. (یک لیتر تمام، چون چگالی آب ۱ است یک لیتر آن یک کیلوگرم می شود)
۳- چهل گرم(یک مول) سدیم هیدرواکسید را به آن اضافه می کنیم (بنابر این از خط نشانه بالا می زند) و به هم می زنیم تا کاملآ حل شود.
بنابر این وزن آن می شود یک کیلو و چهل گرم(هزاروچهل گرم)
اکنون با توجه به مطالب بالا تصویر زیر را ببینید:
تبدیل مولاریته به مولالیته
مثال: مولالیته محلول ۱۸ مولار سولفوریک اسید را به دست آورید. چگالی محلول ۱/۸۴ گرم بر سانتی متر مکعب می باشد.
گام ۱:
فرض کنید یک لیتر محلول داریم
از آنجایی که حجم محلول داده نشده بسیار مهم است که حجم مشخصی برای محاسبه در نظر بگیریم.
گام ۲:
جرم کل محلول را به دست آورید:
گام۳:
تعداد گرم های محلول را به دست آورید:
۱۸ مولار یعنی ۱۸ مول سولفوریک اسید در یک لیتر محلول. ۱۸ مول را به گرم تبدیل می کنیم:
H2SO4=98.09 g/mol
گام۴:
تعداد گرم های حلال را به دست آورید:
گام۵:
مولالیته را حساب کنید:
اپلیکیشن محلول ها: دانلود از مارکت کیان دروید و بازار
برای سهولت در بازبینی وب سایت شیمی کیمیکال و ده ها وب سایت شیمی ایرانی و خارجی دیگر و شبکه های اجتماعی مرتبط و همچنین سهولت در به اشتراک گذاری مطالب آن ها اپلیکیشن رایگان کیمیکال پلاس را نصب کنید.

https://justonly.com/chemistry/chem201/students/handouts/conversion_molarity_to_molality.pdf



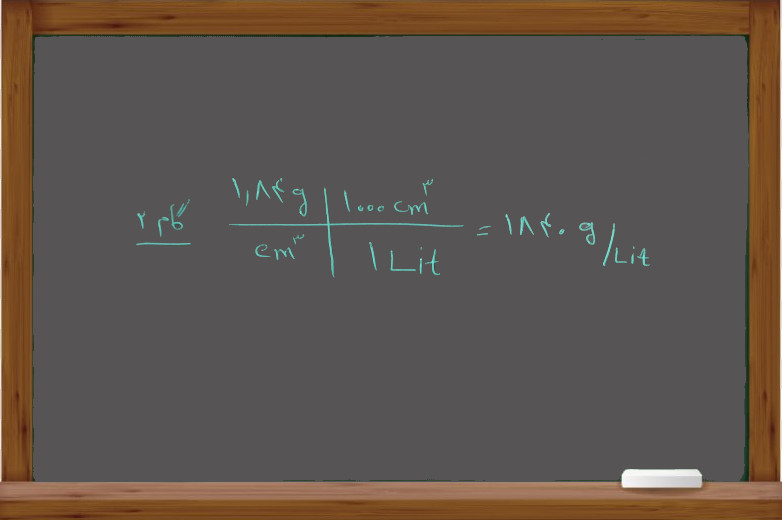
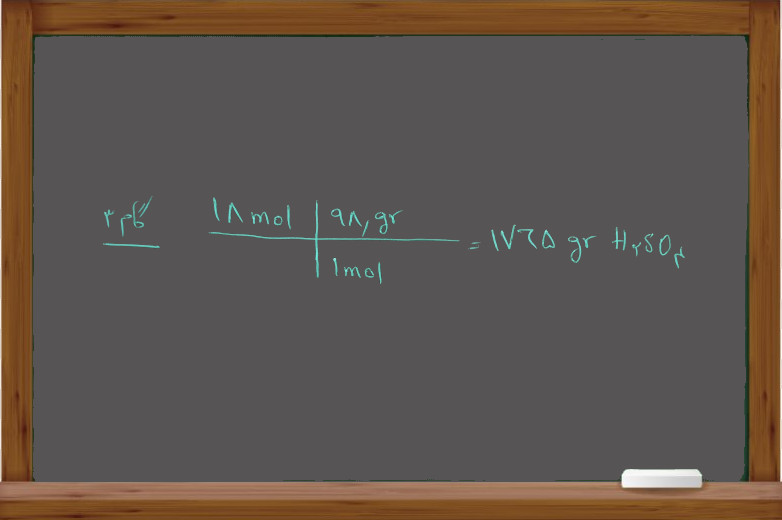





15 Comments
واقعا عالی عالی.ممنون از راهنماییتون
سپاس گزارم
لطفآ مطالب این وب سایت را با دیگران در میان گذارید.
سلام،چرا از مولالیته توی صنعت یا یه محلول گازی استفاده میشه؟؟
ممنون استاد.
[…] تفاوت مولاریته و مولالیته […]
عالیییی مرسییی
کاش نرمالیته رم مینوشتین
درود
این را دیدین؟
http://kimical.ir/normal/
جهانی سپاس از مثال بسیار قابل فهم تان
خیلی ممنونم از راهنمایتان
عالی بود
عالی بود ممنون مختصر و مفید و کامل
سلام
لطفا راهنمائی فرمائید که ph آمونیاک ۲۰ در صد چند است
سلام خسته نباشید چگونه مقدار اسید رابرای یک لیتر اب تخمین بزنیم که ph=3 شود
بستگی به قدرت اسید دارد
اسید قوی و ضعیف فرق دارد
[…] مرتبط با این پست: محاسبات مولاریته تفاوت مولاریته و مولالیته نکات کنکوری شیمی برای فرراگیری بهتر و عمیق تر این بخش […]