اسیدهای اکسیژن دار گوگرد(۲)
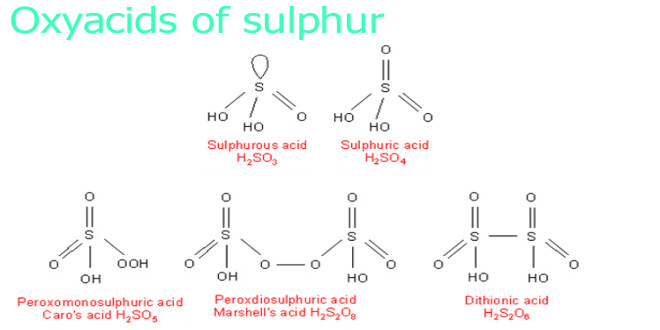
اسیدهای اکسیژن دار گوگرد(۱)
اسفند ۱۹, ۱۳۹۶
سلنیوم Selenum – تلور Telur
اسفند ۲۷, ۱۳۹۶- آموزش شیمی
- آموزش شیمی کیمیکال
- اسیدهای اکسیژن دار گوگرد
- پیرو سولفات
- تری اکسید گوگرد
- جذب آب سولفوریک اسد
- چگالی سولفوریک اسید
- خواص شیمیایی سولفوریک اسید
- خواص فیزیکی سولفوریک اسید
- درجه بومه
- دزیدراتاسیون
- سایت شیمی
- سولفات ها
- سولفات های محلول
- سولفات های نا ملحلول
- سولفوریک اسید
- شیمی
- شیمی سولفوریک اسید
- شیمی گوگرد
- کیان درویدگ
- کیمیکال
- کیمیکال گوگرد
- واکنش روی با سولفوریک اسید
- واکنش قند با سولفوریک اسید
- واکنش کربن با سولفوریک اسید
- واکنش مس با سولفوریک اسید
- واکنش نمک با سولفوریک اسید
- واکنش نمک خوراکی با سولفوریک اسید
- واکنش های سولفوریک اسید
- واکنش هیدرات های کربن با سولفوریک اسید
- واکنش هیدروژن برمید با سولفوریک اسید
- واکنش هیدروژن یدید با سولفوریک اسید
- وب سایت شیمی
- یونیزاسیون سولفوریک اسید
سولفوریک اسید
سولفوریک اسید به فرمول H2SO4 می باشد و از ترکیب تری اکسید گوگرد با یک مولکول آب حاصل می شود و نسبت SO3 به H2O مصرف شده برای تولید آن (1:1) می باشد. هرگاه نسبت میان SO3 و H2O بکار رفته بزرگتر از واحد باشد در آن صورت آن را سولفوریک اسید دود کننده یا اولئوم مینامند.
تهیه ی سولفوریک اسید به دو روش مجاورتی (Contact) و اتاق سربی انجام می شود.
سولفوریک اسید چون خیلی فعال است در طبیعت بحالت آزاد وجود ندارد ولی ترکیبات آن مانند CaSO4 و BaSO4 بمقدار زیاد در طبیعت موجود است. ساختارهای رزونانس سولفوریک اسید به صورت زیر است:
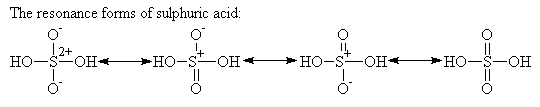
خواص فیزیکی- سولفوریک اسید هم مانند یون سولفات یک چهار وجهی می باشد. سولفوریک اسیدی که خالص باشد بصورت مایعی لزج با چگالی ۱/۸۶ گرم بر سانتیمتر مکعب بوده و نقاط ذوب و جوش آن بترتیب ۱۰/۳۷ و ۲۹۰ سانتی گراد می باشد.
معمولاً در صنعت بجای دانسیته ( بجای وزن مخصوص ) از درجه ی بومه (Baume) برای محلول سولفوریک اسید استفاده می کنند، اگر دانسیته ی سولفوریک اسیدی معلوم باشد با استفاده از رابطه ی زیر میتوان درجه ی بومه ی آلمانی یا فرانسوی را برای آن اسید محاسبه نمود:
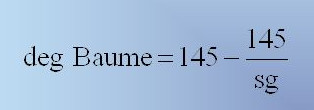
بعنوان مثال اگر درجه ی بومه ی سولفوریک اسیدی را که دانسیته ی آن برابر ۱/۸۲ گرم بر سانتی متر مکعب است حساب کنیم برابر با ۶۵/۰۱ خواهد بود یعنی این سولفوریک اسید ۶۵/۰۱ درجه بومه می باشد.
اسید غلیظ آزمایشگاه ها تقریباً ۹۸% سولفوریک اسید دارد و هنگامی که در آب حل می گردد مقدار زیادی گرما تولید می کند که نتیجه ی هیدراسیون پروتون های اسید می باشد که بصورت زیر می توان نمایش داد:
اگر مقدار ۲۰۰ گرم سولفوریک اسید به ۵۰ گرم یخ اضافه گردد درجه ی حرارت مخلوط تقریباً به ۱۰۰ درجه سانتی گراد خواهد رسید، در حالیکه حجم محلول حاصل از مجموع حجم ۲۰۰ گرم سولفوریک اسید و ۵۰ گرم آب ( آب حاصل از ۵۰ گرم یخ ) کمتر خواهد شد.به علت میل ترکیبی زیادی که سولفوریک اسید غلیظ با آب دارد از آن برای آبگیری (دهیدراتاسیون) و جذب رطوبت از ترکیبات شیمیائی استفاده می شود، سولفوریک اسید قادر است تا ۱۵ برابر وزن خود آب جذب کند و در اثر این خاصیت است که هیدراتهای کربن( مانند قند وشکر) در مجاورت سولفوریک اسید (در نتیجه ی دهیدراتاسیون) سیاه شده و به ذغال (کربن) تبدیل می گردد مانند فرمول زیر:
C12H22O11 + H2SO4 → 12C + 11H2O +11H2SO4
همانطوریکه در پیش گفته شد وقتی که سولفوریک اسید را رقیق می کنند حرارت زیادی تولید می شود(حرارت رقیق نمودن) پس باید وقتی که سولفوریک اسید را رقیق می کنند، سولفوریک اسید غلیظ را کم کم در آب بریزند و بهم بزنند، در غیر اینصورت یعنی در صورت انجام عکس عمل فوق(یعنی با ریختن آب در اسید غلیظ) آب خیلی سریع تبخیر شده و بصورت انفجاری درآمده و اسید را به اطراف پرتاب می کند.
خواص شیمیایی- سولفوریک اسید اسیدی است قوی و علاوه بر اینکه اسیدهای ضعیف را از نمک های آنها جدا می کند می تواند اسیدهای قوی و فرار مانند HCl و HNO3 را نیز از نمک های آنها آزاد نماید(چونکه نقطه ی جوشش سولفوریک اسید بالا می باشد) مثلاً از اثر سولفوریک اسید غلیظ بر کلرید ها(مانند NaCl )گاز HCl آزاد میگردد طبق فرمول زیر:
H2SO4 +NaCl → HCl↑ + NaHSO4
چون سولفوریک اسید اسیدی دی پروتیک است، بدین جهت دارای نمکهای اسیدی( نمکهای دارای یون هیدروژن سولفات) و نمکهای خنثی ( یعنی نمک های دارای یون سولفات ) می باشد که به نمک اسیدی آن سولفات اسید(هیدروژن سولفات) و به نمک خنثی آن سولفات می گویند.و خواص دیگر سولفوریک اسید بقرار زیر است:
الف – یونیزاسیون: محلول سولفوریک اسید (محلول مائی سولفوریک اسید)، مانند یک اسید قوی بوده و یونیزاسیون آن در دو مرحله بصورت زیر انجام می گیرد:
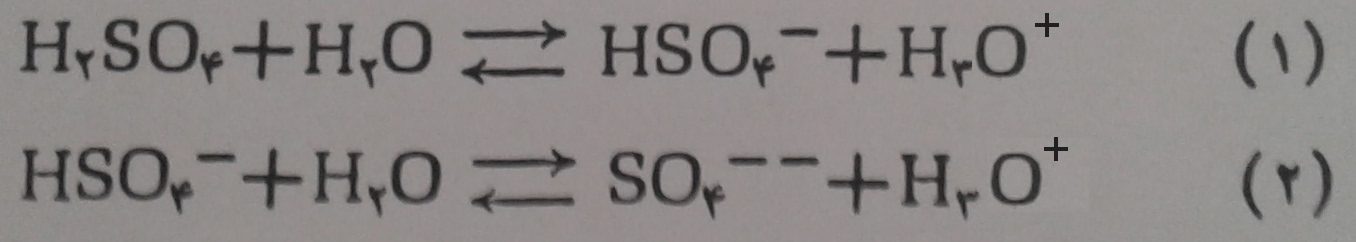
اولین مرحله ی یونیزاسیون آن تقریباً کامل ولی دومین مرحله ی یونیزاسیون ضعیف بوده و کامل نیست و از این جهت است که اگر محلولی از سولفوریک اسید به غلظت یک مولکول گرم در لیتر داشته باشیم(در ۲۵ درجه سانتی گراد) در هر لیتر آن ۰/۹ مول هیدروژن سولفات و درحدود ۰/۱ مول یون سولفات وجود دارد.
همانطوریکه قبلاً هم گفته شده است اسید پیروسولفوریک( محلول غلیظ سولفوریک اسید) از انحلال SO3 در سولفوریک اسید حاصل می شود و فرمول آن H2S2O7 می باشد وبه آن سولفوریک اسید دودکننده یا اولئوم نیز می گویند که به طور قابل ملاحظه ای یونیزه می شود. علاوه بر H2S2O7 (اسید دی سولفوریک) در محلولهای بسیار غلیظ، اسید های پلی سولفوریک دیگری از قبیل H2S3O10 (اسید تری سولفوریک)، H2S4O13 (اسید تتراسولفوریک) پیش بینی شده است که برای همه ی آنها می توان فرمول عمومی زیر را در نظرگرفت:
(SO3)n , H2O
فعلاً وجود دوترکیب H2SO4 و H2S2O7 که مقدار n در آنها به ترتیب ۱ و ۲ می باشد ثابت شده است.
در اولئوم های غلیظ( یعنی اولئومهایی که در آنها مقدار درصد H2S2O7 بوجود آمده بیشتر است، یعنی در اثر حل شدن SO3 بیشتر در سولفوریک اسید تعداد H2S2O7 های بیشتری بوجود آمده باشد) اسیدهای پلی سولفوریک را نتیجه ی تعادل های زیر میدانند:
2H2S2O7
 H2S3O10 + H2SO4
H2S3O10 + H2SO43H2S2O7
 H2S4O13 + H2SO4
H2S4O13 + H2SO4لازم است گفته شود که نمکهای اسید تری سولفوریک شناخته شده است و تا ۱۰۰ درجه سانتیگراد هم پایدار هستند در صورتی که اسید تتراسولفوریک و نمکهای آن را تا حال نشناخته اند.
ب-پایداری: سولفوریک اسید در اثر حرارت به SO3 و H2O تجزیه می گردد بطوریکه در ۳۵۰ درجه سانتی گراد تقریباً ۵۰ درصد مولکول های آن طبق فرمول زیر تجزیه می گردد:
2H2SO4
 SO3↑ + H2O
SO3↑ + H2Oودر حرارت های بالاتر از ۴۳۰ درجه سانتی گراد گاز SO3 حاصل هم طبق فرمول زیر تجزیه شده و گاز SO2 و اکسیژن میدهد:
2SO3
 2SO2↑ + O2
2SO2↑ + O2و در ۱۰۰۰ درجه سانتی گراد در مخلوط حاصل فقط گازهای H2O ، SO2 و O2 وجود دارد که نسبت مولکولی آنها در مخلوط بترتیب ۲،۲و ۱ می باشد بدین جهت است که سولفوریک اسید خالص یا محلول های غلیظ آن در درجه حرارتهای بالا خاصیت اکسیدکنندگی شدیدی از خود نشان میدهند و خصوصیت های شیمیایی محلول های سولفوریک اسید با غلظت محلول های آن ارتباط کامل دارد.
ج- خاصیت اکسیدکنندگی: چون سولفوریک اسید غلیظ در اثر حرارت اکسیژن آزاد می کند در اغلب واکنش ها خاصیت اکسیدکنندگی از خود نشان میدهد.سولفوریک اسید گرم و غلیظ بر اکثر فلزات اثر کرده و آنها را اکسید می نماید مانند اثر آن بر مس که در آن Cu به Cu(II) تبدیل شده و قسمتی از اسیدسولفوریک هم به دی اکسید گوگرد احیا می گردد طبق فرمول زیر:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
سولفوریک اسید گرم و غلیظ، کربن(زغال) را طبق فرمول زیر اکسیده کرده و CO2 تولید می کنند:
C + 2H2SO4 → CO2 + 2SO2 + 2H2O
سولفوریک اسید گرم و غلیظ به آسانی می تواند برمید هیدروژن را اکسید نموده و برم و ید آزاد نماید طبق فرمول های زیر:
2HBr + H2SO4 → Br2 + SO2 + 2H2O
2HI + H2SO4 → I2 + SO2 + 2H2O
چون قدرت احیا کنندگی یدید هیدروژن بیشتر از برمید هیدروژن می باشد با سولفوریک اسید گرم و غلیظ علاوه بر دی اکسید گوگرد محصولات گوگردی دیگری با درجه ی اکسیداسیون پائینی تولید می کنند یعنی علاوه بر واکنش دوم ممکن است واکنش های زیر نیز انجام گیرد:
6HI + H2SO4 → 3I2 + S + 4H2O
8HI + H2SO4 → 4I2 + H2S + 4H2O
دو واکنش آخر در صورت غلیظ بودن محلول HI انجام می گیرند.
محلول های رقیق سولفوریک اسید قدرت اکسیدکنندگی برابر با قدرت اکسیدکنندگی گوگرد در بالاترین درجه ی اکسیداسیون گوگرد در سولفوریک اسید غلیظ و گرم را ندارند و در نتیجه این محلول ها( محلول های رقیق سولفوریک اسید) بر فلزات بالای هیدروژن در جدول تانسیون اثر کرده و هیدروژن آزاد می کنند مانند اثر سولفوریک اسید رقیق بر فلز روی که بصورت زیر می باشد:
Zn + H2SO4 → ZnSO4 + H2
درست است که محلول سولفوریک اسید غلیظ هم بصورت اکسیدکننده عمل کرده است ولی در اینجا عامل اکسیدکننده یونهای هیدروژن حاصل از یونیزاسیون سولفوریک اسید رقیق می باشد و از این جهت است که محلول سولفوریک اسید رقیق بر فلزات بالای هیدروژن( در ستون میل ترکیبی فلزات) اثر می کند ولی بر فلزات پائین هیدروژن ( مانند Cu ، Hg و … ) اثر نمی کند.
سولفات ها- همانطوریکه قبلاً نیز گفته شد گفته شد سولفاتها نمک های خنثی سولفوریک اسید می باشند و از آنها غیر از سولفات باریم BaSO4 و سولفات سرب PbSO4 تقریباً بقیه در آب محلولند، البته بعضی از سولفاتها هم مانند سولفات نقره ی یک ظرفیتی Ag2SO4 ، سولفات جیوه ی یک ظرفیتی Hg2SO4 ،سولفات کلسیم CaSO4 و سولفات استرنسیم SrSO4 کم محلولند.از سولفاتها بعضی بمقدار زیادی در طبیعت موجود می باشند مانند سنگ گچ یا ژیپس به فرمول CaSO4, 2H2
،سولفات منیزیم MgSO4, 2H2 از سولفات های دیگر سولفات باریم BaSO4 یا باریتین و سولفات سدیم Na2SO4
بمقدار کم و بیش در بعضی از کشورها یافت می شوند بطوری که معدن باریتین و سولفات سدیم در ایران نیز موجود است. برای تهیه ی سولفات های خنثی می توان از انحلال فلزات در سولفوریک اسید و یا از اثر سولفوریک اسید براکسید یا هیدروکسید های فلزی استفاده نمود و همچنین از اثر سولفوریک اسید بر روی نمک هایی که اسید مربوطه ی آنها فرار است می توان سولفات بدست آورد.
در میان سولفات ها، سولفات های قلیایی در اثر حرارت تجزیه نمی شود و سولفاتهای فلزات قلیایی خاکی و سرب تا حرارت قرمز پایدار هستند ولی اکثر سولفاتهای فلزات سنگین قبل از اینکه به حرارت قرمز برسند به دی اکسید گوگرد و اکسید فلز بکار رفته در سولفات تجزیه می گردند. برای شناسائی یون سولفات معمولاً آن را در محیط اسیدی بصورت سولفات باریم رسوب میدهند( رسوب مذکور در تمامی اسیدها غیر محلول می باشد) و برای این عمل به سولفوریک اسید یا سولفاتهای محلول، کلرید باریم اثر میدهند تا رسوب سفید و غیر محلول در اسید ها بوجود آید طبق واکنش زیر:
BaCl2 + H2SO4 → BaSO4 + 2HCl
هرگاه منظور شناسایی اسسد سو لفوریک باشد لازم است قبل از اضافه کردن کلرید باریم، خاصیت اسیدی آن توسط معرفها آزمایش شود. اگر منظور از شناسائی سولفاتی جامد ( غیر از BaSO4 ) باشد ابتدا باید آنرا در اسید کلریدریک حل کرده و سپس بر روی آن کلرید اضافه نمود.
بی سولفات ها: بی سولفاتها یا هیدروژن سولفاتها همانطوریکه قبلاً گفته شد نمک اسیدی مربوط به اسید سولوفوریک هستند و در آب محلول بوده و به آسانی هیدرولیز می کردند و محلول آبی آنها حتی آن هایی که از باز های قوی مشتق شده باشند ( مانند NaHSO4 و KHSO4 ) به علت یونیزاسیون یون بی سولفات اسیدی می باشند. هیدروژن سولفات ها یا سولفات اسید ها فقط در مورد فلزات قلیایی شناخته شده است و برای تهیه ی آنها می توان از تبلور محلول سولفاتهای خنثی که با آنها سولفوریک اسید اضافه شده باشد استفاده کرد و یا از تجزیه ی نمکهای قلیائی توسط سولفوریک اسید غلیظ در حرارتهای بالا استفاده نمود( مانند اثر سولفوریک اسید گرم وغلیظ بر NaCl که فرمول آن قبلاً نوشته شده است).هیدروژن سولفاتها در دمای بالاتر از نقطه ی ذوب به پیرو سولفات تبدیل می شوند طبق فرمول عمومی زیر:
2MHSO4 → M2S2O7 + H2O
پیرو سولفات حاصل در اثر افزایش درجه ی حرارت تجزیه شده و SO3 و سولفات خنثی میدهد طبق فرمول عمومی زیر:
M2S2O7 → SO3 + M2SO4
در واکنش های بالا هر M نشان دهنده ی یک اتم فلز قلیایی( مانند سدیم یا … ) می باشد.
نوشته: علی نیکخو
ویرایش: کیان کیانی
دریگر مطالب مرتبط با گوگرد
برای سهولت در بازبینی وب سایت شیمی کیمیکال و ده ها وب سایت شیمی ایرانی و خارجی دیگر و شبکه های اجتماعی مرتبط و همچنین سهولت در به اشتراک گذاری مطالب آن ها اپلیکیشن رایگان کیمیکال پلاس را نصب کنید.






