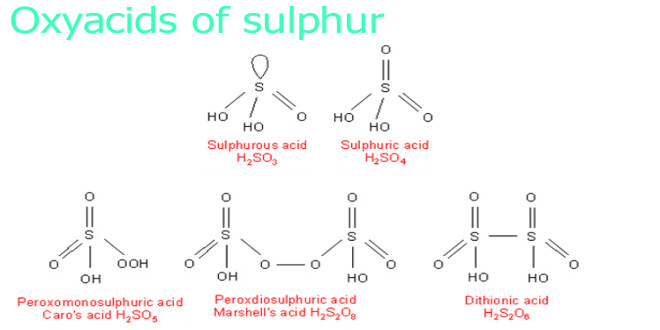
اسیدهای اکسیژن دار گوگرد(۱)
خواص شیمیایی گوگرد تری اکسید
اسفند ۱۶, ۱۳۹۶
اسیدهای اکسیژن دار گوگرد(۲)
اسفند ۲۱, ۱۳۹۶- اتوکاتالیتیک
- اسیدهای اکسیژن دار گوگرد سولفوکسیلیک اسید
- ترکیبات گوگرد
- تیو سولفات سدیم
- خاصیت رنگبری سولفورو اسید
- درجه اکسایش گوگرد در سولفات
- درجه اکسایش گوگرد در سولفیت
- دی تیونو اسید
- دی تیونیت سدیم
- دی تیونیت ها
- دی تیونیت های قلیائی
- دی تیونیت های قلیایی
- سولفوکسیلیک اسید
- شیرآهک
- شیمی ترکیبات گوگرد
- شیمی گوگرد
- علی نیکخو
- فرمول ساختمانی دی تیونو اسید
- کیان کیانی
- هیدرواکسید روی
- واکنش های گوگرد
سولفوکسیلیک اسید S(OH)2 یا H2SO2 : سولفوکسیلیک اسید فوق العاده ناپایدار است و بدان جهت است که بطور آزاد یافت نمی شود و فرمول زیر برای آن در نظر گرفته شده است:


دی تیونو اسید H2S2O4 : اسیدی است ناپایدار و برای تهیه ی آن از الکترولیز محلول سولفیت ها( احیای الکتریکی) استفاده می کنند و گوگرد در این ترکیب دارای اکسیداسیون ۳+ است.
دی تیونو اسید و نمکهای آن اجسامی احیا کننده ی قوی هستند و در رنگرزی از آنها استفتده می کنند.
نمک های دی تیونو اسید را دی تیونیت ها می گویند.
برای تهیه ی دی تیونیت های قلیائی میتوان از اثر گاز دی اکسید گوگرد بر روی ئیدریدهای قلیائی استفاده کرد مانند فرمول زیر:
2SO2 + 2KH → K2S2O4 + H2
اغلب ( درعمل ) Na2S2O4 (سدیم دی تیونیت ) تهیه می کنند و برای تهیه ی آن سولفیت اسید سدیم ( بی سولفیت سدیم NaHSO3 ) را در آب اشباع شده از گاز دی اکسید گوگرد حل می کنند و سپس بر روی آن (درpH برابر ۴ یا ۵) پودر روی ( Zn ) اثر می دهند طبق فرمول زیر:
2NaHSO3 + SO2 + Zn → Na2S2O4 + ZnSO3 + H2O
برای اینکه سولفیت روی حاصل از بین برود بر روی محلول حاصل بمقدار کافی شیرآهک Ca(OH)2 اثر می دهند تا اینکه روی ( یون Zn موجود در ZnSO3 ) به صورت ئیدروکسید روی Zn(OH)2 رسوب کرده و از محلول حاصل در اثر سرد کردن بلورهای Na2S2O4.2H2O جداگردد.
روش دیگر برای تهیه ی دی تیونیت سدیم استفاده از اثر محلول سود سوزان بر دی تیونیت روی ZnS2O4 می باشد که فرمول عمل چنین است:
ZnS2O4 + 2NaOH → Zn(OH)2↓ + Na2S2O4
چون دی تیونیت حاصل دارای مقداری آب تبلور خواهد بود اگر بخواهند دی تیونیت سدیم انیدر به دست آورند لازم است دی تیونیت حاصل را تحت خلأ تا ۵۲ درجه سانتی گراد حرارت دهند ( دی تیونیت انیدر پایدارتر از دی تیونیت آبدار می باشد).
هرگاه دی تیونیت سدیم را حرارت دهند در ۱۰۹ طبق فرمول زیر تجزیه شده و گرما هم تولید می کند:
2Na2S2O4 → SO2 + Na2SO3 + Na2S2O3 + 10KCal
در هوای مرطوبی دی تیونیت سدیم به سولفیت هیدروژن سدیم و تیوسولفات تجزیه می گردد طبق فرمول زیر:
2Na2S2O4 + H2O → 2NaHSO3 + Na2S2O3
هرگاه pH محیط بازی و در حدود(۸) باشد تیوسولفات حاصل( Na2S2O3 ) بر روی دی تیونیت( Na2S2O4 ) اثر نموده و طبق فرمول زیر سولفید هیدروژن و سولفیت هیدروژن تولید می کند:
Na2S2O4 + Na2S2O3 + H2O → NaHS + 3NaHSO3
و در همین شرایط است که ترکیبات حاصل ( یعنی NaHS و NaHSO3 ) بر روی همدیگر اثر کرده و مجدداً تیو سولفات سدیم تشکیل می گردد طبق فرمول زیر:
2NaHS + 4NaHSO3 → 3Na2S2O3 + 3H2O
بطوریکه مشاهده شد ئیدرولیز دی تیونیت سدیم شامل یک فعل و انفعال اتوکاتالیتیک است که به تشکیل تیوسولفات سدیم منجر می گردد.
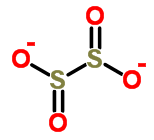
دی تیونیت ها ترکیباتی هستند که خاصیت احیا کنندگی قوی دارند و در اثر اکسیژن هوا به سولفات و سولفورو اسید اکسیده می گردند.
فرمول الکترونی دی تیونیت به صورت زیر است:
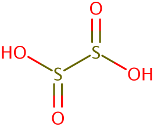
دی تیونو اسید (H2S2O4) را می توان حاصل ترکیب یک مولکول سولفورو اسید با یک مولکول سولفوکسیلیک اسید (H2SO2) دانست که طبق فرمول زیر با همدیگر ترکیب شده و یک مولکول آب از دست داده باشند:
H2SO3 + H2SO2 → H2S2O4 + H2O
فرمول ساختمانی دی تیونو اسید به صورت زیر است:
سولفورو اسید H2SO3: بطوریکه می دانیم سولفورو اسید، اسیدی دی پروتیک است و دونوع نمک از آن به دست می آید، نمک هائی از آن که یک هیدروژن از دست داده اند، هیدروژن سولفیت ( یا بی سولفیت) و نمک هایی که هر دو هیدروژن را از دست داده اند، سولفیت نامیده شده اند.( هیدروژن سولفیت ها نمک اسیدی و سولفیت ها نمک خنثی هستند).
سولفیت:

هیدروژن سولفیت:

همانطوری که قبلاً هم گفته شد برای تهیه ی سولفورو اسید از انحلال SO2 درآب میتوان استفاده کرد.
هرگاه سولفورو اسید را اکسید کنند اسید سولفوریک تولید شده و درجه ی اکسایش گوگرد از ۴+ به ۶+ تغییردمی کند، یعنی سولفورو اسید جسمی احیاکننده می باشد و از این جهت است که موارد استعمال زیادی دارد. سولفورو اسید میتواند( ید محلول در آب دارای یدید پتاسیم) را احیا و به اسید یدیدریک تبدیل نماید طبق فرمول زیر:
H2SO3 + I2 + H2O → H2SO4 + 2HI
وبهمان ترتیب میتواند کلرات پتاسیم را احیا کرده و NaCl و H2SO4 تولبد نماید که فرمول آن بقرار زیر است:
3H2SO3 + NaClO3 → 3H2SO4 + NaCl
و همانطوری که قبلاً نیز گفته شده است سولفورو اسید ( محلول گاز SO2 در آب)علاوه بر خاصیت احیاکنندگی، خاصیت اکسیدکنندگی هم از خود نشان می دهد، بطوری که میتواند H2S را اکسید کرده و گوگرد آزاد نماید و به عبارت دیگر درجه اکسایش ۴+ در H2SO3 و درجه اکسایش ۲- در H2S هردو به صفر می رسند طبق فرمول زیر:
H2SO3 + 2H2S → 3H2O + 3S
خاصیت رنگبری سولفورو اسید – از سولفورو اسید برای رنگبری استفتده می کنند، چون خاصیت آن از خاصیت رنگبری هیپو کلربت ها ضعیفتر ایت، بدین جهت از آن برای رنگبری پارچه های حساسی مانند ابریشمی و پشمی استفاده می کنند.
نوشته: علی نیکخو
ویرایش: کیان کیانی
دریگر مطالب مرتبط با گوگرد
برای سهولت در بازبینی وب سایت شیمی کیمیکال و ده ها وب سایت شیمی ایرانی و خارجی دیگر و شبکه های اجتماعی مرتبط و همچنین سهولت در به اشتراک گذاری مطالب آن ها اپلیکیشن رایگان کیمیکال پلاس را نصب کنید.