سلنیوم Selenum – تلور Telur

اسیدهای اکسیژن دار گوگرد(۲)
اسفند ۲۱, ۱۳۹۶
ملاحضاتی در ساخت مواد رنگ زا
فروردین ۱۵, ۱۳۹۷
دسته ها
تگ ها
بطوریکه می دانیم دو عنصر سلنیوم و تلور از عناصر گروه ششم اصلی هستند و پس از عنصر گوگرد( در گروهVIA) قرار دارند. ترکیباتی که این عناصر با هیدروژن و اکسیژن میدهند مانند ترکیباتی هستند که گوگرد با هیدروژن و اکسیژن درست می کند. سلنیوم و تلور بمقدار زیاد در طبیعت یافت نمی شوند و معمولاً بصورت ناخالصی در ترکیبات گوگردی مخصوصاً در سولفیدها وجود دارند. سلنیوم در سال ۱۸۱۷ توسط شخصی به نام بزرلیوس (Berzelius) در اسید سولفوریکی که از سوزاندن پیریت تهیه شده بود و تلور هم در سال ۱۸۷۲ توسط مولر(Muller) کشف شد. امروزه سلنیوم و تلور بصورت محصول فرعی در تهیه ی اسید سولفوریک بدست می آیند. سلنیوم طبیعی به جرم اتمی ۷۸/۹۶ و عدد اتمی 34 می باشد و دارای شش ایزوتوپ می باشد که به ترتیب افزایش جرم اتمی بقرار زیرند:
۸۲-۸۰-۷۸-۷۷-۷۶-۷۴
درصد فراوانی ایزوتوپ سلنیوم ۸۰ از همه بیشتر و از آن و ایزوتوپ سلنیوم ۷۴ از همه کمتر می باشد.
تلور به جرم اتمی ۱۲۷/۶۱ و بعدد اتمی ۵۲ بوده و دارای هشت ایزوتوپ می باشد که بترتیب افزایش جرم اتمی چنین میباشد:
۱۳۰- ۱۲۸- ۱۲۶- ۱۲۵- ۱۲۴- ۱۲۳- ۱۲۲- ۱۲۰
سلنیوم مانند گوگرد به چندین شکل موجود است، بصورت چهار نوع آلوتروپ بقرار زیر وجود دارد:
۱- سلنیوم شیشه ای ۲- سلنیوم بی شکل ۳- سلنیوم قرمز ۴- سلنیوم خاکستری .از میان آنها سلنیوم قرمز را حرارت دهند به سلنیوم خاکستری تبدیل می گردد (بدون برگشت). سلنیوم قرمز که دارای مولکول Se8 می باشد در دی سولفور کربن حل می شود در صورتی که سلنیوم خاکستری غیر قابل حل در دی سولفور کربن بوده و (بر خلاف سلنیوم قرمز) جریان برق را از خود عبور میدهد. هرگاه بر سلنیوم خاکستری نور بتابانند به تبعیت از نور تابیده شده قابلیت هدایت الکتریکی آن افزایش پیدا می کند و از این خاصیت سلنیوم خاکستری برای سلول فتو الکتریک(یعنی برای ساختن سلول فتو الکتریک سلنیومی) برای اندازه گیری شدت روشنایی( یعنی برای سنجش نور) استفاده می کنند. خاصیت فلزی تلور از سلنیوم هم بیشتر است. تلور نقره ای و متبلور بوده و مقطع آن جلای فلزی دارد. تلور هم مانند سلنیوم دارای دو نوع قهوه ای و یک نوع سفید می باشد. نوع قهوه ای آن شامل آمورف و متبلور می باشد(از نوع متبلور در اثر حرارت دادن نوع آمورف تولید می شود)، نوع سفید آن بلوری است و اگر تلور مایع رابطیی سرد نمایند به تلور سفید تبدیل می شود( نقطه ی ذوب تلور ۴۰۲ می باشد).
همانطوریکه گفتیم سلنیوم دارای مولکول های هشت اتمی یعنی بصورت Se8 می باشد و چون خواص آن شبیه خواص گوگرد است وقتی به مایع تبدیل می گردد هر قدر که درجه ی حرارت آن بالا می رود تعداد اتمهای تشکیل دهنده ی مولکول آن کاهش پیدا می کند و بطوریکه در بخارات آن بتدریج تعداد اتمهای سازنده ی مولکول کم شده و تا تشکیل Se2
(مولکول دو اتمی) در دمای ۱۷۰۰ درجه سانتی گراد ادامه پیدا می کند و در بالاتر از آن در جه ی حرارت، سلنیوم ، به صورت تک اتمی در می آید. (یادآوری میشود که نقطه ی جوش سلنیوم ۶۸۵ درجه سانتی گراد می باشد).
تلور هم تا دمای ۱۸۰۰ درجه سانتی گراد بصورت Te2 در می آید و در درجه حرارت های بالاتر از آن تبدیل شدن به مونو اتمی شروع شده و در ۲۰۷۰ درجه سانتی گراد تمامی آن بصورت اتمهای تنها( یعنی بصورت منواتمی) وجود دارد.
خواص شیمیایی سلنیوم و تلور- خواص شیمیایی سلنیوم و تلور شباهت زیادی به گوگرد دارد با این تفاوت که هر چه از گوگرد به طرف تلور میرویم از مقدار الکترو نگاتیویته ی عناصر کاسته میشود بطوریکه تلور در مقایسه با گوگرد خاصیت فلزی ضعیفی پیدا می کند.
سلنیوم تحت اثر حرارت، مستقیماً میتواند با هیدروژن ترکیب شده و سیلند هیدروژن (سلنوز هیدروژن) H2Se
گازی شکل بوجود آورد در صورتی که ترکیب مستقیم تلور با هیدروژن و تهیه ی تلور ید هیدروژن H2Te امکان پذیر نیست. برای تهیه ی H2Se و H2Te میتوان از اثر اسیدها بر روی تلور یدها و سلنیدها استفاده کرد. سلنیوم و تلور هم مانند گوگرد در اکسیژن میسوزند و دی اکسید سلنیوم (انیدرید سلنیو) یعنی SeO2 و دی اکسید تلور( انیدرید تلورو) TeO2 بوجود می آورند که هر دوتای آنها برخلاف اکسید گوگرد در دمای معمولی جامدند و اسید های مربوط به آنها یعنی H2SeO3 (اسیدسلنو) و H2TeO3 (اسید تلورو) خواصی مانند خواص اسید سولفورو دارند. اکسیدهای با عدد(6+) سلنیوم و تلور یعنی تری اکسید سلنیوم(انیدرید سلنیک) SeO3 و تری اکسید تلور(انیدرید تلوریک) TeO3 خواص شیمیایی مشابه با تری اکسید گوگرد(انیدرید سولفوریک) SO3 از خودشان نشان میدهند، از اسیدهای اکسیژندار دیگر سلنیوم و تلور می توان اسید سلنیک H2SeO4 و اسید تلوریک H2TeO4 را نام برد که قدرت اکسیدکنندگیشان از اسید سولفوریک بیشتر است. اسید سلنیک دارای ساختمان چهار وجهی و اسید تلوریک دارای ساختمان هشت وجهی است( یعنی اتم تلور با پیوند کوئووالانسی با شش گروه هیدروکسیل متصل شده است) که فرمول ساختمانی و شکل فضایی آنها بقرار زیر می باشد:
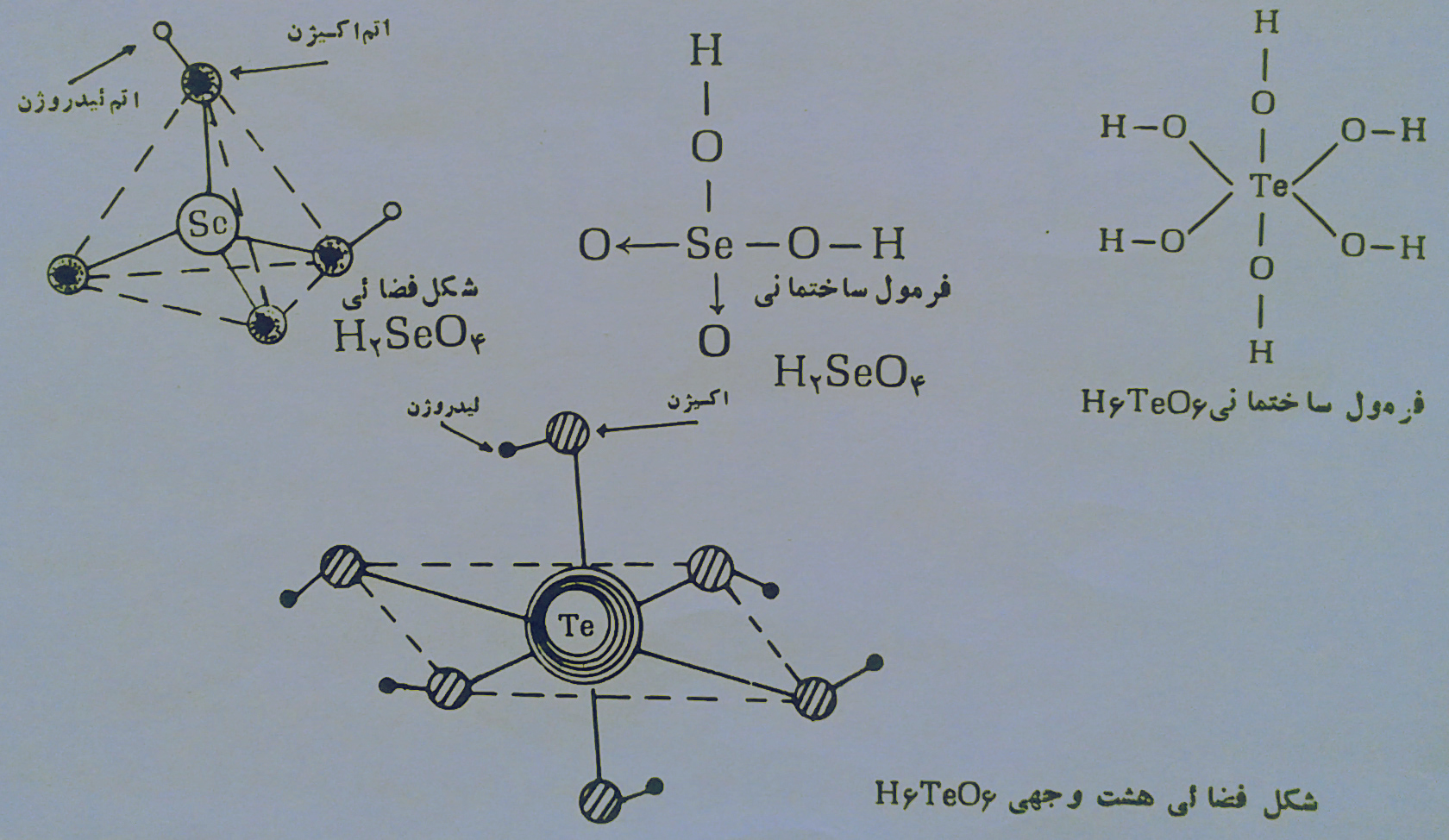
باید یادآوری شود که اسید تلوریک به فرمول H2SeO4, 2H2O ناپایدار تر از اسیدهای مشابه خانواده گوگردی میباشد.
به H6TeO6 یا به Te(OH)6 اسید ارتو تلوریک و به H2TeO4 اسیدمتاتلوریک می گویند. همانطوریکه گوگرد مستقیماً در حرارت با هالوژنها ترکیب می شود، سلنیوم و تلور هم می توانند مستقیماً با هالوژنها(با فلوئور در سرما و با کلر و برم در اثر حرارت) ترکیب و یک سری هالید تولید کنند مانند هگزا فلوئورید سلنیوم SeF6 و هگزا فلوئورید تلور TeF6 که خواص آنها شبیه هگزا فلوئورید گوگرد SF6 می باشد.
طرز تهیه ی سلنیوم و تلور: همانطوریکه از سوزاندن سولفید ها، دی اکسید گوگرد حاصل می شود از سوزاندن سلیندها(سلنور ها) و تلوریدها(تلورورها) نیز اکسیدهای آنها یعنی SeO2 و TeO2 حاصل می شود(که در دمای معمولی جامد می باشند) و در موقع تهیه ی اسید سولفوریک در غبارگیر و یا اطاق های سربی رسوب می نمایند(یعنی دی اکسید سلنیوم و دی اکسید تلور رسوب می کنند) و آنوقت به رسوبات مذکور آب اثر میدهند و از انحلال آنها( یعنی از انحلال اکسیدهای سلنیوم و تلور) در آب اسید سلنو و اسید تلورو حاصل می شود، حال اسیدهای حاصل را توسط سولفورو طبق فرمول های زیر احیا کرده، سلنیوم و تلور بدست می آورند:
H2SeO3 + 2H2SO3 → 2H2SO4 + H2O +Se
H2TeO3 + 2H2SO3 → 2H2SO4 + H2O +Te
سلنیوم حاصل از واکنش بالا قرمز رنگ است و در اثر حرارت به سلنیوم خاکستری رنگ تبدیل می شود که دارای خاصیت فلزی است.
روش تشخیص سلنیوم و تلور- سلنیوم و تلور در اسید سولفوریک غلیظ(دودکننده) حل شده و رنگ های مشخصی بوجود می آورند طبق فرمول های زیر:
Se + H2SO4 → SeSO3 + H2O
Te + H2SO4 → TeSO3 + H2O
بطوریکه از فرمول های فوق مشاهده می شود سلنیوم در اثر اسید سولفوریک غلیظ پس از حل شدن تولید ترکیبی به رنگ سبز و تلور تولید ترکیبی به رنگ قرمز می نماید. اگر در واکنش های فوق به محلول آب اضافه نمایند هردو واکنش برگشت پذیر می شوند یعنی واکنش از راست به چپ برگشت میکند و به عبارت دیگر سلنیوم قرمز و تلور سیاه به صورت رسوب پدیدار می گردد و از این طریقه (روش) برای شناسایی سلنیوم و تلور استفاده می گردد.
پولونیوم (Polonium)- عنصری است از گروه(VIA) که برای اولین بار در سال ۱۸۹۸ هنگام تجزیه ی سنگ های اورانیوم توسط آقا و خانم کوری کشف شد و عنصری است که از رادیم رادیو آکتیوتر می باشد. پولونیوم خواص کاملاً فلزی دارد و در محلول های اسیدی به یون Po(II) تبدیل می گردد و نجابت آن از فلز نقره بیشتر است، برای اینکه وقتی فلز نقره در محلول آن یعنی در محلول دارای Po(II) وارد می شود و عمل جانشینی انجام می گیرد.( یعنی از فلز نقره در اثر یونیزاسیون کنده شده و به صورت یون نقره در ظرف می ریزد و در عوض پولونیوم( Po ) روی میله نقره ای رسوب می کند). خواص شیمیایی آن در بعضی جهات به تلور و از بعضی جهات دیگر مشابه بیسموت می باشد.
مقایسه ی خواص عناصر گروه (VIA) با یکدیگر: هرگاه خواص عناصر این گروه را بررسی نماییم خواهیم دید که خواص این عناصر هم مانند خواص عناصر گروه های دیگر تغییر می کند یعنی هر چه در این گروه جرم اتمی عناصر افزایش پیدا می کند خاصیت فلزی آنها افزایش و خاصیت غیر فلزی آنها کاهش پیدا می کند و به عبارت دیگر اکسیژن و گوگرد با اینکه خاصیت غیر فلزی کاملی دارند، از عنصر سلنیوم ببعد خاصیت فلزی بیشتر ظاهر می گردد.
در این گروه هر چه جرم اتمی عناصر افزایش پیدا می کند قدرت اسیدی مربوط به آنها بیشتر کاهش می یابد بطوریکه اسید سولفوریک اسیدی قوی است و اسید سلنیک ضعیفتر و اسید تلوریک از آنهم ضعیفتر می باشد و به عبارت دیگر هر چه به طرف پولونیوم حرکت کنیم قدرت اسیدی اسیدهای اکسیژندار عناصر این گروه کاهش می یابد.
درعناصر این گروه پایداری ترکیبات (با عدد اکسیداسیون ۶+ عناصر) با افزایش جرم اتمی کاهش می یابد مثلاً SO3 خیلی پایدارتر از SeO3 است. تمامی عناصر این گروه در ترکیب با هیدروژن و فلز (یعنی در موقع ترکیب با عناصر الکتروپوزیتیو) درجه ی اکسیداسیون (2-) پیدا می کنند. حداکثر عدد اکسیداسیون عناصر این گروه ۶+ است(یه استثنا اکسیژن).
نوشته: علی نیکخو
ویرایش: کیان کیانی




