کنکور شیمی
نکات کنکوری شیمی
- همه
- آزمایش های شیمی
- آزمایش های شیمی-تصویری
- ابوالفضل امیراعظمی
- اطلاعات فنی رنگرزی و چاپ
- افسانه حبیبی
- اکسایش کاهش
- الکترونیک و برق
- الهام کامران پور
- امیر حسین غریبی
- ایمان انصاری
- پرمنگنات
- پوستر
- تازه ها
- تعادل ها
- چگالی
- حقایق شیمی
- داستان های شیمی
- دبیرخانه صنایع شیمیایی
- رزومه های شیمی
- رضا زمانی
- روز مول ایرانی
- زهرا فراهانی
- زهرا(ماه بانو) سادات
- سلماز حیدریان
- سمیرا داتلی بیگی
- شکر
- شهاب نوشمند
- شیمی آلی
- شیمی برای بچه ها
- شیمی تجزیه
- شیمی در آشپزخانه
- شیمی در خانه
- شیمی صنعتی
- شیمی عمومی
- شیمی معدنی
- شیمی نساجی
- شیمی و سرگرمی
- صابر رشتاک
- طیف نگاری و اختر شیمی
- غلظت ها
- کنکور شیمی
- کیان کیانی
- گوگرد
- مائده کوهی
- محمد طاها نادری زاده
- مریم علی اصغری
- مقالات
- منصوره حامدی
- مول
- نرم افزار
- نگار آقاکابلی
- نویسندگان
- نیتروژن
- نیلوفر یاوری
- همه
-
- -ریحانه نظری
- -فاطمه اردیخانی
- -فاطمه شرفی زاد
- -نجمه شکاری
- : الهام کامران پور- کارشناس ارشد شیمی معدنی
- «تله گرد و غبار» در اطراف ستاره دور ممکن است معمای تشکیل سیاره را حل کند
- ۱۲ نکته درباره ی الماس و گرافیت
- A380
- Abbe
- Absorption Chiller
- advantages of fuel cells
- Air Travel
- airbus
- Aircraft Fuel
- Airlines
- Ammonia
- Athanol
- atlantic ocean
- aviation
- B-57 Tupolev aircraft
- B-57هواپیمای توپولوف
- battery . Safer Fuel
- BFD مشخص کردن مجهول نقشه
- Biochemical
- Blue Odyssey
- BMW
- BOD
- Boeing
- Britten-Norman
- c2h5oh
- Canada
- Car Charging
- car charging infrastructure
- Car Show
- carbon reduction
- Catalyst
- CCHP system
- CCHP system dynamic characteristics
- CCHP system economic analysis
- CCHP راندمان
- CCHP هیدروژن
- CCHP ویژگی های دینامیکی سیستم
- CFM International
- challenges of fuel cells
- Chemical engineering
- chemistry background
- chemistry background iran
- clean energy
- clean energy generation
- climate change
- CO2 reduction
- CO2 تامین حرارت پیل سوختی
- Coal
- COD
- College
- combustion chamber
- consumption Fuel
- Controller
- Cooling Pump
- CoQ10
- Created: Artist Kaycie D
- Crossover
- DA20
- decarbonization
- Dehumidification
- Density Flow
- Diamond DA20
- disadvantages of fuel cells
- DLR
- DO
- Double aircraft
- Drone
- Dubai
- EC
- ECBT
- EDTA
- efficiency
- electric vehicles
- Electrolyzer
- Energy
- energy consumption
- Energy Exports
- Energy Integration
- Energy News
- Energy News شهاب نوشمند
- energy sources
- environmental laws
- Environmental Protection
- Finland
- Flight
- Fly zero
- Ford
- fossil fuels
- France
- Fresson
- Fuel cell
- fuel cell catalyst
- fuel cell fuel
- fuel cell heating
- Fuel Cell News
- fuel cell stack
- Fuel Cell Use
- fuel Safer fuel
- function (value) { return $.inArray(value
- FZM
- Gas appliances
- gas turbines
- global warming
- Green ammonia
- Green energy
- Green Hydrogen
- Greenhouse Gases
- Ground Heating
- H2S
- Heat Storage Tank
- Heat Supply
- Heating decarbonization
- Heating System
- high energy
- High Voltage
- History of Hydrogen Aircraft
- Home Heating
- HPLC
- HY4
- Hybrid
- Hydrogen
- hydrogen aircraft
- Hydrogen Economy
- hydrogen engines
- hydrogen extraction
- hydrogen fuel
- Hydrogen Fuel Station
- Hydrogen Hydrogen
- Hydrogen Leak Detector
- Hydrogen News
- hydrogen production
- Hydrogen production price
- hydrogen propulsion
- Hydrogen Sensor
- Hydrogen Station
- hydrogen storage
- hydrogen strategy
- hydrogen taxis
- hydrogen transportation
- hydrogen truck
- Hydrogen Turbines
- hydrogen vehicles
- hydrogen-based heating supply
- Imperial College London
- India
- interest Energy side
- internal combustion engine
- Invert
- Japan
- Jet fuel
- Kappa 77
- Kawasaki
- Kaycie D
- Key Words: Shahab Nooshmand
- kian kiani
- kiandroid.ir
- kimical.ir
- ksp
- liquid hydrogen
- Lithium Batteries
- Madain
- Malaysia
- Marine Fuels
- Martin
- Martin Aircraft
- Methane
- Minibus Hydrogen
- Mogalacona Mine
- Nanocapsules
- NASA
- Natural gas
- Nitrogen
- Nottingham
- Oman
- Ontario
- OSK
- Paris Agreement
- Partial Oxidation Reformer
- Passenger aircraft
- pH
- Phantom Eye
- Piston engine
- pollution
- Ports
- Power Generation
- ppm
- Proton Exchange Membrane Fuel Cell
- Proton Exchange Membrane Fuel Cell شهاب نوشمند
- Proton Exchange Membrane Fuel Cell کلید واژه ها: شهاب نوشمند
- pvc
- Radiolysis
- refract
- refraction
- Renault
- renewable diesel
- Renewable energies
- renewable energy
- Renewable Ship
- Russia
- Sarawak
- Shahab Nooshmand
- Ship Acceptance Number
- Shipping
- shipping triangle
- Slovakia
- Solar Energy
- Solar Installations
- Solar panels
- South Africa
- South Korea
- Sustainable Hydrogen Economy
- Synthetic Polymers
- TDS
- temperature stabilization
- The Hydrogen Utility Pty Ltd
- Thermochemical
- this); }
- three way catalyst
- tnt
- Toyota Corolla
- transportation
- TU-155 test flight
- TU-155 پرواز آزمایشی
- turbofan
- turboprop
- turmeric
- UAE
- UASB
- UK
- Ukraine
- University of Oil and Gas
- University of Sheffield
- University of Tajikistan
- University of Warwick
- vehicle charging
- waste to hydrogen conversion
- Water Economy
- Wind turbines
- ZERI
- Zero Avia
- zero carbon
- zero pure carbon
- آب
- آب + اکسید فلزات قوی
- آب + اکسید نافلزات
- آب آهک-شیر آهک کلسیم سولفات
- آب اکسیژنه
- آب باریت
- آب برگشتی
- آب تازه
- آب تبلور
- آب تفاله
- آب در سحابی جبار
- آب دگازور
- آب ژاول
- آب سنگین
- آب شیرین
- آب شیشه
- آب شیشه بسازید
- آب کندانس
- آب کوره
- آب مس کاری
- آب مقطر
- آب مقطر گیر خورشیدی
- آب نرم
- آب های آرسنیک
- آب های آهن دار
- آب های طبیعی لاغری
- آب های گوگردی
- آب های معدنی
- آب های معدنی اسیدی
- آب های معدنی لاغری
- آب های ید دار
- آب و ایزوتوپ های اکسیژن و هیدروژن
- آبکاری الکتریکی
- آبی برلن
- آپارات پخت
- آتش بازی
- آتش سوزی بوسیله آب
- آتنا دارابی نیا
- آذرهش
- آراکس شیمی
- آرام آذین فر
- آرایش الکترون نقطه ای
- آرایش الکترون نقطه ای ساختار لوئیس
- آرایش الکترونی
- آرایش الکترونی عناصر
- آرایش الکترونی عناصر واسطه
- آرایش چشم
- آرزو احمدی
- آرزو امیری
- آرزو دهقانی
- آرزو شفیعی
- آرش رحیمی
- آرش رحیمی بافرانی
- آرش قوی بیان
- آرگون
- آرمان معنوی
- آرمین معنوی
- آروماتیک
- آریا میرزایی
- آزمایش آئینه نقره ای
- آزمایش آینه نقره ای
- آزمایش انحلال گاز کلر در آب
- آزمایش با ترکیبات سدیم و پتاسیم
- آزمایش بایر
- آزمایش بشام
- آزمایش جابه جایی فلزی
- آزمایش حلالیت ید
- آزمایش رونگه
- آزمایش محلول هزار چهره
- آزمایش های آلومینیم
- آزمایش های سیلیسیم
- آزمایش های شیمی
- آزمایش های گوگرد
- آزمایش هینزبرگ
- آزمایش ویژگی آمفوتر روی اکسید
- آزمایشگاه رازی
- آزمایشگاه هنرستان فنی رازی
- آزیتا رحیمی
- آژورایت
- آسیب به چشم
- آشنایی اجمالی با نرم افزار Hysys
- آشنایی با برخی از روشهای طیفسنجی در شیمی
- آشنایی با دانش شیمی
- آشنایی با مواد شیمیایی
- آفریقای جنوبی
- آفریقای جنوبی پیل سوختی
- آفینه
- آلایندگی
- آلاینده ها
- آلبیت
- آلفانفتول
- آلکان ها
- آلکین ها
- آلما نظری فرد
- آلوتروپی گوگرد
- آلوتروپی های سلنیوم
- آلومینیم
- آلومینیم هیدرو اکسید
- آلومینیوم
- آمادگی کنکور شیمی
- آمریسیوم
- آمفوتر
- آمنه رحیمی
- آموزش شیمی
- آموزش شیمی آلی
- آموزش شیمی تصویری
- آموزش شیمی دبیرستان
- آموزش شیمی دهم
- آموزش شیمی کنکور
- آموزش شیمی کیمیکال
- آموزش شیمی یازدهم
- آموزش عناصر
- آموزش مول
- آموزش نانو مقدماتی
- آموزش نرم افزار مستر نوا
- آموزش نرم افزار مستر نوا MestreNova
- آموزش نرم افزار مسترنوا
- آموزش و آزمایش چگالی
- آمونیاک
- آمونیاک سبز
- آمونیم نیترات چیست
- آمیدها
- آمین ها
- آمینو اسیدها
- آنالیز طلا
- آنالیز فلزات نجیب
- آنالیز مواد درون تخم مرغ
- آنتالپی
- آنتالپی پیوند فلئور
- آنتالپی پیوند کلر
- آنتروپی
- آنتوروپومتری وسایل حفاظت فردی
- آنتیموان
- آنچه یک آزمایشگاه باید داشته باشد
- آنیون
- آهک
- آهک زنده کلسیم هیدرواکسید
- آهک هیدراته
- آهن
- آهن اکسید
- آهن ربا
- آهن(III)اکسید
- آهن(III)سیترات
- آهن(III)نیترات
- آهنگ مصرف رنگ غذا
- آوا قوی بیان
- آیا می توان روی کلرید و سدیم کلرید را با استفاده از از سولفید هیدروژن شناسایی کرد
- آیا می دانید شیمی
- آیدا اجدادی
- آیدا بهمنی
- آیدا توکلی
- آیدا مرادی
- آیدا یزدانی
- آیسان افشار
- آیلار افشار
- آیناز بهادری
- آیناز خدابندهلو
- آیناز گرامی
- ابر مولکولی قوس
- ابر مولکولی کمان
- ابعاد
- ابوالفضل امیراعظمی
- ابوالفضل امیراعظمی کارشناس ارشد شیمی فیزیک
- ابوالفضل حیدری
- ابوالفضل زیارتی
- ابوالفضل عرفانی
- اپ شیمی
- اپ شیمی معدنی دکتر یوسفی
- اپ شیمی معدنی سمیه غلامی
- اُپتیکال
- اُپتیمم
- اپلیکیشن آموزش محلول ها در شیمی
- اپلیکیشن از اتم تا استو کیومتری
- اپلیکیشن از اتم تا استوکیومتری
- اپلیکیشن اکسایش کاهش
- اپلیکیشن اندرویدی
- اپلیکیشن اندرویدی محلول ها
- اپلیکیشن تبدیل واحد
- اپلیکیشن تبدیل واحد پارسی
- اپلیکیشن سمیه غلامی
- اپلیکیشن شیمی
- اپلیکیشن شیمی آلی
- اپلیکیشن شیمی معدنی
- اپلیکیشن شیمیست
- اپلیکیشن کیمیکال پلاس
- اپلیکیشن محاسبه گر شیمی
- اپلیکیشن محلول ها
- اپلیکیشن معادله واکنش بساز و موازنه کن
- اپلیکیشن های شیمی
- اپلیکیشن های کیان دروید
- اتانول
- اتم
- اتم گرم
- اتمسفر سامانه خورشیدی
- اتمسفر منظومه شمسی
- اتمیسیته
- اتوکاتالیتیک
- اتیل یا ایزوپروپیل الکل
- اتین
- اثر آب اکسیژنه بر روی آب چغندر در محیط اسیدی، بازی و خنثی
- اثر آب بر منو اکسید گوگرد
- اثر احیاکنندگی هیدروژن سولفید
- اثر اسید سولفوریک گرم و غلیظ بر کربن
- اثر اسید سولفوریک گرم و غلیظ بر گوگرد
- اثر اسید سولفوریک گرم و غلیظ بر مس
- اثر اسید سولفوریک گرم و غلیظ بر نقره
- اثر اسید سولفوریک گرم و غلیظ جیوه
- اثر برم بر گاز اتیلن
- اثر بی اکسید ازت بر گاز اتیلن
- اثر پرمنگنات بر گاز اتیلن
- اثر داپلر در ستاره شناسی
- اثر داپلر در نجوم
- اثر دما بر سرعت واکنش
- اثر رویینگی
- اثر ساختمان الکترونی گوگرد بر روی خواص فیزیکی آن
- اثر سطح روی واکنش
- اثر غلظت بر سرعت واکنش
- اثر فلوئور بر گوگرد
- اثر گاز اتیلن بر برم
- اثر گاز اتیلن بر بی اکسید از
- اثر گاز اتیلن بر محلول پرمنگنات قلیایی
- اثر گاز اتیلن در کلر
- اثر گاز کلر بر اتیلن
- اثر گوگرد بر اکسیدهای قلیایی و قلیایی خاکی
- اثر گوگرد بر اکسیژن
- اثر گوگرد بر الماس
- اثر گوگرد بر بر
- اثر گوگرد بر برم
- اثر گوگرد بر روی
- اثر گوگرد بر سیلیسیم
- اثر گوگرد بر فلئور
- اثر گوگرد بر فلزات
- اثر گوگرد بر فلزها
- اثر گوگرد بر کادمیم
- اثر گوگرد بر کربن
- اثر گوگرد بر کلر
- اثر گوگرد بر مس
- اثر گوگرد بر نیتروژن
- اثر گوگرد بر هالوژن ها
- اثر گوگرد بر هیدروژن
- اثر گوگرد بر ید
- اثر مقدار بیندر در ثبات سایش چاپ با مواد رنگزای پیگمنت
- اثر نیتریک اسید بر فلزات
- اثر هالوژن ها بر منو اکسید گوگرد
- اثر هیدروژن سولفید بر فلزات
- اثر هیدروژن سولفید بر نمک ها
- اثر هیدروفلئوریک اسید بر استخوان
- اثر هیدروفلئوریک اسید بر بدن
- اثر هیدروفلوئوریک اسید بر بدن
- اثر هیدروفليوریک اسد بر استخوان
- اثر هیدروفليوریک اسد بر بدن
- اثرCoQ10 بر روی پوست
- اثریون مشترک
- اجزاء اتم
- اجزای اصلی یک خودروی پیل سوختی
- احتراق هیدروژن/ الکترولیز آب
- احسان نصیری
- احسان نصیری سود پرک
- احسان نیکبخت
- احمد تکلو
- احمد قبادی
- احمد کیان کروندی
- احیا روضه ای
- اخبار انرژی
- اخبار پیل سوختی
- اخبار پیل های سوختی
- اخبار هیدروژن
- اختر شیمی
- اخترشیمی
- ادیتور آنلاین شیمی
- ادیسه آبی
- اربیوم
- ارتباط علوم با یکدیگر
- ارتو
- ارتوسولفورو اسید
- ارزش حجمی
- ارسلان سرشوق
- ارسنیک
- ارگونومی
- اریفیس متر
- از اتم تا استوکیومتری
- از بین بردن آبی برلن
- از بین بردن انواع لکه ها
- از بین بردن لکه از روی سنگ مرمر
- از بین بردن لکه از روی مرمر
- از بین بردن لکه ها
- از کوپریک به کوپرو
- ازبین بردن آکنه باآب اکسیژنه
- ازت
- اساس اسپکتروسکوپی
- اساس رنگ
- اسانس پوست پرتقال
- اسانس تربانتین
- اسپری ضد بخار عینک
- اسپکتروسکوپی
- اسپکتروفتومتر
- اسپکترول
- استاد مهدی اسحاقی
- استارت آپ
- استامینوفن
- استانیک اکسید
- استثناها در عناصر واسطه
- استحصال نیترات
- استخراج اسانس پوست پرتقال
- استخراج جیوه
- استخراج قلع
- استخراج قلع با الکترولیز
- استخراج گوگرد
- استخراج لیمونن
- استخراج نقره
- استخراج نقره و جیوه
- استخراج هیدروژن
- استراتژی هیدروژن
- استرانسیوم
- استرنژیت
- استفاده از اسید و باز
- استفن
- استک پیل سوختی
- استک پیل های سوختی
- استوکیومتری
- استوکیومتری ترکیبات
- استوکیومتری واکنش
- استوکیومتری واکنش دهنده ها
- استولزیت
- استیک اسید
- استیلبن
- استیلن
- استیلن تنها آلکینی است که دو هیدروژن اسیدی دارد
- اسرا چوبتاشانی
- اسکاندیم
- اسلواکی
- اِسلوری
- اسماعیل فضل جو
- اُسمز
- اسید
- اسید + باز
- اسید بوریک
- اسید پرتقال
- اسید سولفوریک
- اسید سولفوریک اولئوم
- اسید سولفوریک دودکننده
- اسید سیا نیدریک
- اسید ضعیف
- اسید فرمیک
- اسید قوی
- اسید لیمو
- اسید میوه ها
- اسید نیتریک
- اسید و باز
- اسید و باز شیمی دوازدهم
- اسید و باز ضعیف
- اسید و باز قوی
- اسید وباز قوی و ضعیف
- اسیدها بازها را خنثی می کند
- اسیدها و باز ها
- اسیدها و بازها در بدن ما
- اسیدها و بازها در طبیعت
- اسیدهای آمینه
- اسیدهای اکسیژن دار گوگرد
- اسیدهای اکسیژن دار گوگرد سولفوکسیلیک اسید
- اشباع
- اصطلاحات رایج صنعت قند
- اصل لوشاتولیه
- اصلاح رویش بذر
- اصلاح کننده اکسیداسیون جزئی
- اصول و مقررات ایمنی در صنایع رنگ و رزین
- اضافه کردن NaOH رقیق به یون روی در محلول
- اضافه کردن سدیم هیدرو اکسید رقیق به یون روی
- اضافه کردن محلول آمونیاک به یون روی در محلول
- اضافه کردن هیدروژن سولفید به یون روی در محیط قلیایی
- اطمه بوستانیان
- اعداد کوانتومی
- اعداد کوانتومی مولکول: انواع پیوند(یونی
- افزودن H2S به یون روی در محیط قلیایی
- افسانه حبیبی
- افسانه حبیبی کارشناس شیمی کاربردی
- اقتصاد آبی
- اقتصاد هیدروژن پایدار
- اقتصاد هیدروژنی
- اقیانوس اطلس
- اکسایش الکل
- اکسایش توسط کرومیک اسید
- اکسایش کاهش
- اکسایش کلروفرم
- اکسید
- اکسید اسیدی
- اکسید کننده قوی
- اکسید کننده های قوی
- اکسیداسیون الکل
- اکسیدها
- اکسیدها شیمی دهم
- اکسیدها و اسیدهای اکسیژن دار گوگرد
- اکسیدهای آمفوتر
- اکسیدهای اسیدی
- اکسیدهای اسیدی، بازی، آمفوتر و خنثی
- اکسیدهای بازی
- اکسیدهای گوگرد
- اکسیژن
- اکسیژن + فلز
- اکسیژن + نافلز
- اکسین سود
- التراسونیک
- الکترو شیمی تلگرام
- الکترو لومینسانس
- الکتروپوزتیوی
- الکترود
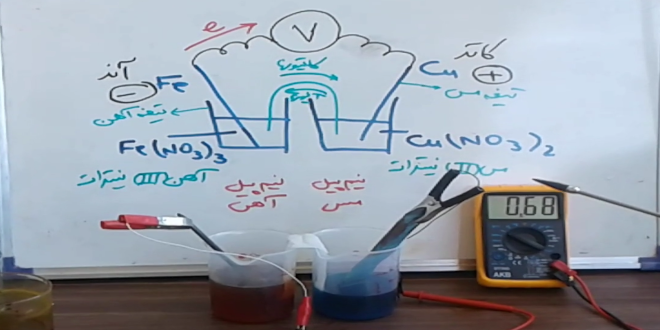
- الکتروشیمی
- الکتروشیمی لومینسانس
- الکترولایزر
- الکترولیت
- الکترولیز
- الکترولیز قلع(II) کلرید
- الکترولیز کلرید قلع
- الکترولیز محلول سدیم سولفات
- الکترولیز نمک خوراکی
- الکترولیز نمک طعام
- الکترولیز نمک های فلزات قلیایی
- الکترومغناطیس
- الکترونگاتیوی
- الکترونگاتیوی در جدول تناوبی
- الکترونیک
- الکترونیک آلی
- الکل
- الکل ارزان
- الکل سفید
- الکل صنعتی
- الکل طبی
- الکل متیلیک
- الکل ها و مشتقات آن
- الماس
- المیرا خواجه منصوری
- الهام السادات حکیمی
- الهام کامران پور
- الهام کامران پور کارشناس ارشد شیمی معدنی
- الهام ملایی
- الهام ملکی
- الهام ملکی پاورپوینت شیمی
- الهام ملکی شیمی
- الهه باوی
- الهه حیدری
- الهه شهلایی
- الهه کریمی
- الیاف کربن
- امارات متحده عربی
- امانوئل شارپنتیر
- امپریال کالج لندن
- امتحان آنیلین با آزمایش رونگه
- امتحان هینزبرگ
- امواج ترمودینامیک
- امواج رادیویی
- امیر اعظمی
- امیر اعظمی نکات کنکوری
- امیر حسین رنجبر بیدل
- امیر حسین شجاع کردار
- امیر حسین عباسی
- امیر حسین غریبی
- امیر حسین منوچهری
- امیر حسین یوسفی
- امیر طالبی
- امیر طالبی پاورپوینت شیمی
- امیر محمد احمدی
- امیر محمد حکیم نیا
- امیر مهدی شیردل
- امیراعظمی
- امیراعظمی اکسایش کاهش
- امیرحسین غریبی
- انتاریو
- انتشار اپلیکیشن شیمی معدنی دکتر یوسفی
- انتشار شیمی
- انتشار مطلب شیمی در اینترنت
- انجام محاسبات رنگرزی
- انجلال
- انجمن شیمی
- انحلال
- انحلال آلومینیم
- انحلال اتیلن گلیکول
- انحلال پنبه
- اندازه گیری اکسیژن حل شده در آب با رنگ سنجی
- اندازه گیری پیک آپ
- اندازه گیری جریان الکتریکی
- اندازه گیری چگالی
- اندازه گیری چگالی نمک محلول در آب
- اندازهگیری کرومیک اسید محلول
- اندازهگیری کرومیک اسید محلول از طریق رسوب سنجی
- اندروید شیمی
- انرژی
- انرژی اکتیواسیون
- انرژی بالا
- انرژی پاک
- انرژی پیوند
- انرژی خورشیدی
- انرژی فعال سازی
- انرژی های تجدید پذیر
- انرژی های نو
- انرژی های نو در دنیای امروزی
- انرژی یکپارچه سازی
- انرژی یونش
- انشتینیوم
- انعقاد پنبه
- انفجار
- انفجار آمونیم نیترات
- انفجار سولفوریک اسید و پرمنگنات
- انفجار کوتوله های سفید
- انفجار هندوانه
- انکسارسنج
- انگشت نگاری
- انواع آب از نظر ایزوتوپی
- انواع آب از نظر جرم مولکولی شیمی ۱
- انواع اکسید ها
- انواع اکسیدها
- انواع بمب ها و انرژی حاصل از انفجار بمب
- انواع جامدات(اتمی
- انواع رنگ های مستیم
- انواع کوره ها
- انواع نانوکپسول ها
- انواع نشر خودبخودی
- انواع واکنش های اکسایش کاهش
- انواع واکنش های شیمیایی
- انواع واکنش های هسته ای
- انوع پاک کننده شیشه های حساس
- انیدرید
- انیدرید سولفورو
- انیدرید سولفوریک
- انیدرید کربنیک
- انیس سادات صالحی نژاد
- اهمیت علم شیمی در پرستاری
- اِوابراسیون
- اواپراتور
- اوپال
- اورانیوم
- اوربیتال d
- اورتو ، متا ، پارا
- اورتو نیترو تولوئن
- اوزون
- اوکراین
- اولئوم
- ایت اکسید کنندگی پر منگنات
- ایتربیوم
- ایرباس
- ایریتیم
- ایزو سیانات ها
- ایزوپروپیل الکل
- ایزوپروپیل الکل ٪۹۹
- ایزوپروپیل الکل ۷۰٪
- ایزوتوپ
- ایزوتوپ های طلا
- ایزوتوپ های گوگرد
- ایزوتوپهای اکسیژن و هیدروژن
- ایستگاه هیدروژن
- ایلنینیت
- ایلیا گلابی
- ایمان انصاری
- ایمنی در آزمایشگاه
- ایمنی و ماشین آلات صنعتی
- ایندیگو کارمین
- ایندیم
- با هم پیل بسازیم
- باباربیع
- باتوکرومیک
- باران طلایی
- باران محمدی زاده
- باروت
- باروت سپید
- باروت سفید
- باروت سیاه
- بارومتریک
- باریت
- باریم
- باریم هیدرواکسید
- باز
- باز شیف
- باز ضعیف
- باز قوی
- بازشیف
- بازها
- بازها اسیدها را خنثی می کنند
- بازها با چربی ها واکنش می دهند
- بازها مزه گس دارند
- بازی
- بازیابی کیسه های برای استفاده دوباره
- باستناسیت
- باشگاه پژوهشگران جوان و نخبگان
- باطری لیتومی
- بافر
- بافر استیک اسید و سدیم استات
- بافرآمونیاک
- بالاترین درجه اکسایش
- بالاترین عدد اکسایش
- بالاترین عدد اکسایش هر عنصر
- بالاترین و پایین ترین درجه اکسایش
- بتائین
- بخار گوگرد
- براق کردن برنج
- براق کردن سنگ مرمر
- براق کردن طلا
- براق کردن فلزات
- براق کردن قلع
- براق کردن کروم
- براق کردن لینولئوم
- براق کردن مرمر
- براق کردن مس
- برای های لایت کردن آب اکسیژنه
- برج خنک کننده
- برخی اسید ها اگر حرارت داده شوند به اکسید نافلز و آب تجزیه می شوند
- برخی اکسید ها در اثر حرارت تجزیه می شوند
- برخی مواد در اثر الکتریسیته تجزیه می شوند
- برداشت لکه ید
- بررسی آهنگ واکنش
- بررسی انحلال چند ترکیب
- بررسی پیوند با ریاضی
- بررسی دما
- بررسی رابطه ضریب با سرعت متوسط
- بررسی زمان
- بررسی سرعت
- بررسی سرعت متوسط واکنش
- بررسی عوامل موثر در چگونگی و زمان نگهداری مواد غذایی
- بررسی عوامل موثر در سرعت واکنش
- بررسی فشار
- بررسی لایه نشانی به روش کندوپاش
- بررسی یکاهای سرعت متوسط
- برطرف کردن بوی بد
- برطرف کردن بوی بد بدن بدون استفاده از دئودورانت
- برطرف کردن لکه های آلی اورگانیک
- برقکافت
- برقکافت کلرید قلع
- برکلیوم
- برگرداننده: رضا زمانی
- برگرفته از کتاب تست های شیمی کالج های انگلستان
- برلیوم
- برلیوم در کجای زمین یافت می شود
- برم
- برم تیمول بلو
- بریتانیا
- بریکس
- بریکس سنج
- بسامد
- بسته بندی سود پرک
- بشرا میرزایی
- بکگراند شیمی
- بلاند
- بلاند ZnS
- بلانکیت
- بلانکیت کلسیم اکسید
- بلور طلا
- بلور های زمان
- بلور یا کریستال
- بلورها
- بلورها چگونه تشکیل می شوند
- بلورهای طبیعی
- بلورهای معدنی
- بلورهای منوکلینیک گوگرد بسازید
- بمب اتمی پسر کوچیک
- بمب شیمیایی فسژن
- بمب شیمیایی کلر
- بمب هسته
- بنادر
- بنزوئیک اسید
- به دست آوردن فرمول تجربی و مولکولی
- بهار علامرو دشتی پور
- بهار مالیی
- بهار ملایی
- بهترین سایت های شیمی
- بهجت مصلحی
- بهداشت در صنایع حفاظت ماشین های صنعتی
- بهداشت شغلی
- بهره وری انرژی
- بهنود بحرانی
- بو زدایی از پارچه های بد بو شده
- بوئینگ
- بور
- بوراکس
- بوریک اسید
- بوریوم
- بوگیر
- بومه سنج
- بوی بد شبیه بوی تخم مرغ گندیده
- بی ام و
- بی کربنات سدیم
- بی هوازی
- بیتا امامدادی
- بیتا امدادی
- بیتا رحیمی
- بیتا شفیعی
- بیتا فرخی
- بیسموت
- بیشتر هیدرو اکسید های فلزی وقتی گرم شوند به اکسید فلز و آب تجزیه می شوند
- بیکرومات پتاسیم
- بیماری های ناشی از عوامل مکانیکی
- بیو ویتا
- بیوشیمیایی
- بیولوژیک
- بیولومینسانس
- پارا
- پارا نیترو تولوئن
- پارافوشین
- پارسا مولایی
- پارمیدا ساسانی مقدم
- پاسیو شدن
- پاک کردن آبی برلن
- پاک کردن چربی از شیشه
- پاک کردن چربی از شیشه حساس
- پاک کردن چربی سخت از شیشه
- پاک کردن چرم
- پاک کردن زغال از شیشه حساس
- پاک کردن سنگ دیگ
- پاک کردن سنگ مرمر
- پاک کردن سیاهی طلا
- پاک کردن طلا
- پاک کردن کروم
- پاک کردن لینولئوم
- پاک کردن مرمر
- پاک کردن نقره
- پاک کننده شیشه های حساس
- پالادیم
- پالایش نفت خام
- پاورپوینت
- پاورپوینت انرژی های نو
- پاورپوینت ایمنی در آزمایشگاه
- پاورپوینت دروس شیمی
- پاورپوینت شهره فردادوند
- پاورپوینت شیمی
- پاورپوینت شیمی رنگ
- پاورپوینت نانو لوله های کربنی
- پاورپوینت های شیمی
- پاورپوینت های شیمی پارسی
- پاورپوینت های شیمی فارسی
- پاورپوینت واکنش های فلزات واسطه
- پاورپویینت
- پایان نامه
- پایان نامه شیمی
- پایداری گوگرد دی اکسید
- پایه رنگ
- پتاس پتاسیم هیدرواکسید
- پتاس سوزآور
- پتاسیم
- پتاسیم پر منگنات
- پتاسیم پرمنگنات
- پتاسیم تری یدید
- پتاسیم تیوسیانات
- پتاسیم دی کرومات
- پتاسیم فری سیانید
- پتاسیم کربنات
- پتاسیم کرومات
- پتاسیم نیترات
- پتاسیم یدات
- پتاسیم یدید
- پتری دیش
- پخت
- پدیده کاویتاسیون
- پر اکسی دی سولفوریک اسید
- پرازئودیمیم
- پراش
- پراش اشعه ایکس و طیفسنجی فوتوالکترون پرتو ایکس
- پراش نور چیست
- پرایمر پلاستیک
- پرتقال
- پرتوکافت
- پرتوهای پس زمینه مایکروویو کیهانی
- پرزنت شیمی رنگ
- پرسش های آرایش الکترونی
- پرسش و پاسخ شیمی
- پرسش و پاسخ محلول ها
- پرشولاژ
- پرمنگنات
- پرمنگنات پتاسیم
- پرمنوسولفوریک اسید
- پرواز
- پروتاکتنیوم
- پروژه Extreme H
- پرومتیم
- پریا شیروانی
- پریا صیدی
- پریا مولایی
- پریسا ناظری ثانی
- پریشان ابوئی
- پریشان ابوئی دانشجوئی ارشد شیمی معدنی
- پریناز عالیپور
- پس زمینه شیمی
- پس زمینه ی شیمی
- پساب
- پل نمکی چیست
- پلاریزه
- پلاریمتر
- پلاسما
- پلاسما با جریان مستقیم
- پلاسما با جریان مستقیم(DCP) یا جت پلاسما
- پلوتونیم
- پلوتونیوم
- پلی اتن
- پلی اتیلن
- پلی سولفورهای ئیدروژن یا سولفانها (Sulfanes)
- پلی سولفورهای قلیایی
- پلی سولفید
- پلی سولفیدهای قلیایی
- پلی هیدروکینولین
- پلیمر طیب شاه علی زاده تلگرام
- پلیمرهای مصنوعی
- پمپ خنک کننده
- پنبه کوهی آلومینیم پتاسیم سولفات
- پنبه نسوز آهن(II) سولفات
- پنتاسولفید
- پنج عنصر موفقیت
- پنل های خورشیدی
- پهباد
- پوست پرتقال
- پوستر
- پوستر تست شعله
- پوستر حلالیت نمک ها
- پوستر رنگدانه های معدنی
- پوستر ستاره شناسی
- پوستر شیمی
- پوستر شیمی شیشه رنگی
- پوستر شیمی شیشه های رنگی
- پوستر شیمی فشفشه ها
- پوستر مول
- پوستر نجوم
- پوستر های شیمی
- پوستر واحد جرم اتمی
- پوستر یون های رنگی
- پوسترهای شیمی
- پولونیوم
- پویا بصیری نژاد
- پی اچ
- پی اچ آب اکسیژنه
- پی اچ متر
- پی پی ام
- پی دی اف شیمی
- پی دی اف های شیمی
- پی وی سی
- پیدا کردن درصد قند
- پیرو سولفات
- پیروسولفورو اسید
- پیروسولفوریک اسید
- پیرومورفیت
- پیریت
- پیریت آهن
- پیستوله دو جزیی
- پیشرانه های هیدروژنی
- پیشگیری از آتش سوزی و انفجار
- پیشنهاد روز مول ایرانی
- پیگمنت
- پیل
- پیل الکتروشیمیایی
- پیل الکتروشیمیایی (آهن-مس)
- پیل سوختی
- پیل سوختی ایمن تر
- پیل گالوانی
- پیل های سوختی غشاء پروتون (پلیمری)
- پیوند با صنعت
- پیوند داتیو
- پیوند فلزی
- پیوند قطبی
- پیوند قطبی و غیر قطبی
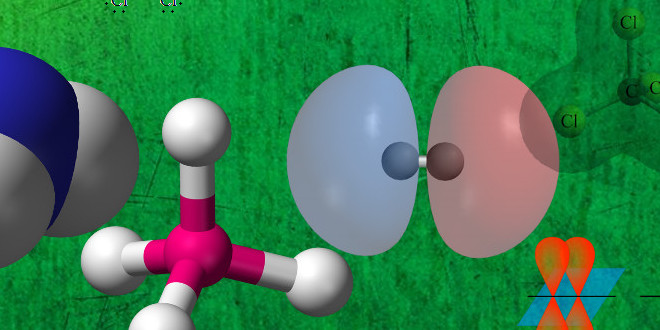
- پیوند کووالانسی
- پیوند نا قطبی
- پیوند نیروی واندروالس
- پیوند هیدروژنی
- پیوند یونی
- پیوندهای شیمیایی
- تابش پوزیترون
- تابش گاما
- تاریخچه اسپاترینگ
- تاریخچه پیدایش گالیم
- تاریخچه هواپیماهای هیدروژنی
- تازه های هیدروژن و پیل سوختی
- تاسیسات خورشیدی
- تاکسی های هیدروژنی
- تالار شیمی
- تالامتر PPM
- تامپون
- تامین حرارت
- تامیین گرمایش مبتنی بر هیدروژن
- تایپ: سام قلی پور
- تبدیل پی پی ام به مولار
- تبدیل دبی جرمی
- تبدیل دبی جرمی و حجمی
- تبدیل دبی جرمی و حجمی به یکدیگر
- تبدیل درصد جرمی جرمی به جرمی حجمی
- تبدیل زباله به هیدروژن
- تبدیل مولار به پی پی ام
- تبدیل مولار و پی پی ام به همدیگر
- تبدیل مولاریته به مولالیته
- تبدیل نقره
- تبدیل واحد
- تبدیل واحدهای دما به یکدیگر
- تبدیل یکاهای سرعت
- تبلور گوگرد سوزنی
- تبلور نمک
- تترا سولفید تترا ازت
- تترا سولفید تترا نیتروژن
- تترا سولفید دی نیتروژن
- تترا هیدروژن سولفید
- تتراکلرید کربن
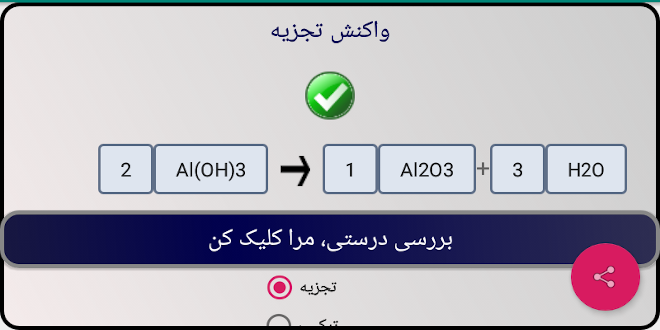
- تجزیه
- تجزیه آلومینیم سولفات
- تجزیه سزکوئی اکسید گوگرد
- تجزیه و تحلیل اجزای پیل سوختی غشای تبادل پروتون برای تامین انرژی یک وسیله نقلیه
- تجهیزات فرایندی
- تحلیل اقتصادی سیستم
- تحولی در اخترشیمی با تلسکوپ رادیویی ALMA
- تخلیه الکتریکی
- تخم گذاری
- تخم مرغ
- تخم مرغ و روش تولید آن
- تدریس آنلاین شیمی فنی حرفه ای
- تدریس خصوصی در اصفهان
- تدریس خصوصی شیمی
- تدریس شیمی
- تدریس شیمی آنلاین
- تدریس شیمی با نگاه کاربردی
- تدریس شیمی حضوری
- ترافیک
- تربیوم
- ترجمه متون شیمی
- ترکیب
- ترکیب + عنصر
- ترکیب دوتایی
- ترکیب گوگرد با فلزات
- ترکیب های شیمیایی گیاهان
- ترکیبات آرسنیک
- ترکیبات آلی در منظومه شمسی
- ترکیبات آلی گوگرد دار
- ترکیبات آلی نیتروژن دار
- ترکیبات رنگی فلزات واسطه
- ترکیبات گوگرد
- ترکیبات معدنی به عنوان رنگدانه در نقاشی
- ترکیبات منگنز
- ترکیبات هتروسیکل
- ترمودینامیک
- ترموشیمیایی
- ترنم شهابی
- تری اکسید گوگرد
- تری اکسید گوگرد آلفا
- تری اکسید گوگرد بتا
- تری اکسید گوگرد گاما
- تری کلراتین
- تری هیدروژن سولفید
- تری یدو متان
- تست آروماتیک ها
- تست بنزن
- تست شعله
- تست شعله برای سدیم و پتاسیم
- تست شیمی
- تست شیمی آلی
- تست کنکور سراسری
- تست های شیمی
- تست های شیمی کالج های انگلستان
- تست ید با نشاسته
- تسهیم نامتناسب
- تشخیص اتانول از متانول
- تشخیص اثر انگشت مجرم
- تشخیص ناخالصی در آسپیرین
- تشخیص یون روی
- تشکیل بلور مس(II) سولفات
- تشکیل بلورهای پتاسیم نیترات
- تشکیل بیولوژیکی کربنات کلسیم
- تشکیل رسوب
- تشکیل ید با آب اکسیژنه
- تصفیه
- تصفیه آب
- تصفیه آب با پرمنگنات
- تصفیه آب با زاج سپید
- تصفیه بیولوژیکی
- تصفیه خانه صنعتی کارخانه قند
- تصویر ساز سریال برکینگ بد(افسارگسیخته)
- تعادل اسید کربنیک و گاز دی اکسید کربن
- تعادل ها
- تعادل های شیمیایی
- تعاریف اسید و باز
- تعداد الکترون
- تعداد پروتون
- تعداد نوترون
- تعریف اتم گرم
- تعریف انرژی یونش
- تعریف ظرفیت
- تعریف مول
- تعریف مولاریته
- تعریف مولکول گرم
- تعریف واکنش اکسایش کاهش
- تعریف یون گرم
- تعین عیار با سنگ محک( سنگ لیدی)
- تعین عیار به روش ذوب قلیایی
- تعین عیار،تشخیص،تلخیص وآنالیز فلزات نجیب توسط
- تعین عیارطلا
- تعین عیارطلا ذوب قلیلیی
- تعیین درصد الیاف پنبه ویسکوز
- تعیین درصد پارچه پنبه ویسکوز
- تعیین درصد مخلوط انواع پارچه پلی استر، پنبه، ویسکوز
- تعیین دوره و گروه عناصر واسطه
- تعیین غلظت نقره نیترات
- تعیین نقطه جوش بنزن
- تغیرات شعاع اتم
- تغییر
- تغییر الکترونگاتیوی در جدول تناوبی
- تغییر رنگ آب چغندر در محیط اسیدی، بازی و خنثی
- تغییر عدد اکسایش منگنز
- تغییرات اقلیمی
- تغییرات شعاع در جدول تناوبی
- تفاله تر
- تفاله خشک
- تفاوت اختر شیمی و شیمی کیهان
- تفاوت باز با قلیا
- تفاوت باز با قلیایی
- تفاوت بازی با قلیایی
- تفاوت بین پیوند الکترووالانسی( یونی) و کووالانسی
- تفاوت بین تیتراسیون اسید باز و اکسایش کاهش
- تفاوت بین عناصر بلوک d و عناصر واسطه
- تفاوت بین مولاریته و مولالیته
- تفاوت ثابت گاز ایده آل و ثابت ویژه گازها
- تفاوت میان ایزوپروپیل الکل(IPA) ٪۹۹ و ۷۰٪
- تفاوت میان مواد رنگزای دیسپرس، حلال و خمی
- تفاوت نورهای مکمل و مواد رنگی مکمل
- تفاوت واکنش گاز کلر با سود سرد و رقیق و گرم و غلیظ
- تفاوت ید و تنتورید
- تفکیک یونی اسیدها بازها
- تقویت کننده ها و مرطوب کننده های پوست
- تقویتی شیمی
- تکلیس
- تکلیس سنگ آهک
- تکمیل چیست
- تکمیل درکالای نساجی
- تکنسیم
- تگزاپون
- تلسکوپ رادیویی
- تلفظ شیمی تخصصی
- تلفظ واژه های شیمی تخصصی
- تلگرام
- تلور
- تمرین های اضافی شیمی
- تمیز کردن تشت و وان باآب اکسیژنه
- تمیز کردن سطح کاشی ها باآب اکسیژنه
- تمیز کردن مرطوب کننده های هوا
- تمیزکردن چربی گوش باآب اکسیژنه
- تناسب یا استوکیومتری
- تنتورید
- تندآب
- تنفس مصنوعی
- تهیه آب اکسیژنه
- تهیه آب اکسیژنه بررسی خواص آن
- تهیه آب لحیم
- تهیه آب لحیم کاری
- تهیه آبژاول در خانه
- تهیه آزمایشگاهی آب اکسیژنه
- تهیه آسپیرین
- تهیه آمونیاک
- تهیه آمونیاک در آزمایشگاه
- تهیه آنیلین
- تهیه آنیلین با نیتروبنزن
- تهیه آنیلین به روش کاهش ترکیبات نیترو
- تهیه آنیلین در آزمایشگاه
- تهیه اتان
- تهیه اتان از هیدرولیز منیزیم اتیل برمید
- تهیه اتانول
- تهیه اتر خشک
- تهیه اتر مطلق
- تهیه اتیل الکل
- تهیه اتیلن
- تهیه اتیلن از الکل
- تهیه اتیلن از الکل و سولفوریک اسید
- تهیه اتیلن از سولفوریک اسید
- تهیه اتیلن در آزمایشگاه
- تهیه الکل اتیلیک
- تهیه الکل از شکر
- تهیه الکل به روش تخمیر
- تهیه الکل در خانه
- تهیه الکل در منزل
- تهیه بنزن از بنزوئیک اسید
- تهیه پتاسیم کربنات
- تهیه پتاسیم نیترات در آزمایشگاه
- تهیه دئودورانت در خانه
- تهیه رژ لب در خانه
- تهیه رونگالیت
- تهیه ژلاتین
- تهیه سرکه در خانه
- تهیه سولفانیلیک اسید
- تهیه سولفید ئیدروژن از گوگرد
- تهیه صابون در خانه
- تهیه صابون در خانه با چربی حیوانی
- تهیه صنعتی آب اکسیژنه
- تهیه ضد عرق در خانه
- تهیه فسژن
- تهیه فنل فتالئین
- تهیه کرم نرم کننده
- تهیه گاز آمونیاک
- تهیه گاز اتان
- تهیه گاز اتیلن
- تهیه گاز کلر از اثر اسید کلریدریک بر بی اکسید منگنز
- تهیه گاز کلر از الکترولیز محلول نمک طعام
- تهیه گاز کلر از جوهر نمک و آب ژاول
- تهیه گاز کلر از جوهر نمک و هیپوکلریت سدیم
- تهیه گاز کلر از جوهر نمک و وایتکس
- تهیه گاز کلر از هیدروکلریک اسید و وایتکس
- تهیه گاز کلر از واکنش بین هیدروکلریک اسید(جوهر نمک) و پتاسیم پر منگنات
- تهیه گاز کلر در آزمایشگاه
- تهیه گاز متان
- تهیه گوگرد هگزا فلئورید
- تهیه مایع دست شویی
- تهیه مایع دست شویی و ظرف شویی در خانه
- تهیه مایع ظرف شویی
- تهیه متیل اورانژ
- تهیه متیل نارنجی
- تهیه نیتریک اسید در آزمایشگاه
- تهیه هالیدهای هیدروژن
- تهیه هالیدهای هیدروژن در آزمایشگاه
- تهیه هالیدهای هیدروژن در صنعت
- تهیه هلیانتین
- تهیه هیدروژن برمید
- تهیه هیدروژن پر اکسید
- تهیه هیدروژن سولفید
- تهیه هیدروژن سولفید (سولفید ئیدروژن) در آزمایشگاه
- تهیه هیدروژن فلئورید
- تهیه هیدروژن کلرید
- تهیه هیدروژن یدید
- تهیه و ساخت شیشه پاک کن
- تهیه وایتکس در خانه
- تهیه ی محلول شوایتزر
- تهیه ید در آزمایشگاه
- توافقنامه پاریس
- توان پیرامون
- توربوپراپ
- توربوفن
- توربین های بادی
- توربین های گازی
- توربین های هیدروژنی
- تورمالین
- تورنسل
- توسعه هیدروژن سبز
- توسعه ی اپلیکیشن های شیمی پارسی
- تولوئن
- تولید آمونیاک
- تولید انرژی
- تولید انرژی پاک
- تولید پتاسیم نیترات
- تولید رنگ فلئورسنت
- تولید شکر
- تولید شکر از چغندر قند
- تولید قند
- تولید قند و شکر
- تولید گاز اتان
- تولید گاز خانگی
- تولید گاز کلر
- تولید گاز متان از تقطیر چوب
- تولید گاز متان از تقطیر زغال سنگ
- تولید گاز متان از زغال سنگ
- تولید گاز متان از سدیم استات و آهک
- تولید گاز متان با آهک
- تولید گاز متان با تقطیر خشک چوب
- تولید گاز متان با زغال سنگ
- تولید گاز متان با سدیم استات
- تولید گاز متان به وسیله آهک
- تولید گاز متان به وسیله چوب
- تولید محتوای شیمی
- تولید مواد شیمیایی
- تولید نور جادویی
- تولید هیدروژن
- تولید هیدروژن از عمل اسید روی فلز
- تولیم
- تویوتا کرولا
- تی ان تی
- تیتانیم
- تیتانیم کوارتز
- تیتراسیون
- تیتراسیون اسید و باز
- تیتراسیون اکسایش کاهش
- تیتراسیون رسوبی
- تیتراسیون محلول پرمنگنات
- تیتراسیون محلول پرمنگنات و محلول گوگرد دی اکسید
- تیتراسیون های اکسایش-کاهش ردوکش
- تیزآب سلطانی
- تیغه آهنی
- تیغه مسی
- تینا طاهر غلامی
- تینا غلامی
- تینا کشن رنجبر
- تیو سولفات سدیم
- تیوسیونات پتاسیوم
- تیول ها
- ثابت تعادل
- ثابت دی الکتریک
- ثابت گاز ایده آل
- ثابت نگه داشتن دما
- ثبت کردن اثر انگشت
- ثمین هادی
- جا به جایی مس با آهن
- جامدات اتمی
- جامدات فلزی
- جامدات کووالانسی
- جامدات مشبک
- جامدات مولکولی
- جامدات یونی
- جانشینی دوگانه
- جانشینی ساده
- جانشینی هیدروژن آب با یک فلز فعال
- جانشینی یک فلز در یک ترکیب با یک فلز فعال تر
- جایگاه سوخت هیدروژن
- جایگاه لومینسانس
- جت پلاسما
- جدا کردن گلیسیرین از صابون
- جداسازی اسانس پوست پرتقال
- جدول آرایش الکترون نقطه ای
- جدول اسیدهای قوی و ضعیف
- جدول تناوبی
- جدول تناوبی (پوستر)
- جدول تناوبی عناصر
- جدول تناوبی عناصر اصلی
- جدول حلالیت مواد
- جدول حلالیت نمک ها
- جدول کاتیون ها و آنیون های چند اتمی
- جدول کاتیون ها و آنیونهای رایج
- جدول مقایسه استاندارد رنگ مصرفی
- جذب آب سولفوریک اسد
- جذب نور
- جذب و نشر
- جذب و نشر تابش
- جرم اتمی
- جرم اتمی متوسط
- جرم حجمی
- جرم مخصوص
- جریان چگالی
- جزوه آموزشی شیمی دهم
- جزوه کامل رسم ساختارلوئیس
- جزوه های آموزشی شیمی دهم
- جلسه کلاس کنکور شیمی(چهار جلسه تدریس و چهار جلسه تست) گنجانده شد که شامل بخش های: اتم: مواد خالص و نا خالص
- جلوگیری از عفونت گوش شناگران باآب اکسیژنه
- جمع بندی شیمی ۲
- جنگل سیلیکون خودتان را بسازید
- جنیفر دودنا
- جوش شیرین
- جوهر تورشک سدیم دی تیونیت
- جوهر حسن لبه لاکتیک اسید
- جوهر دُرد اگزالیک اسید
- جوهر سرکه فرمیک اسید
- جوهر سقز
- جوهر شوره
- جوهر شوره سولفوریک اسید
- جوهر طلایی
- جوهر قره قوروت تارتاریک اسید
- جوهر قند
- جوهر گوگرد
- جوهر مورچه
- جوهر مورچه بنزوئیک اسید
- جوهر نمک استیک اسید
- جیوه
- جیوه(II)کلرید
- چاپ آبی
- چاپ آبی Blue Print
- چاپ آبی کیمیکال
- چاپ با شابلون
- چاپ برداشت
- چاپ پیگمنت
- چاپ خمی
- چاپ شبه برداشت
- چاپ کالای نساجی با رنگ های پیگمنت
- چالش های پیل های سوختی
- چرا انجمن های شیمی پارسی
- چرا ریشه ی چغندر قرمز است
- چرا مرکز یخ کدر است
- چرا مرکز یخ کدر است؟
- چربی زدایی سود کاستیک
- چرخش نور
- چشم انداز نقش هیدروژن در انتقال انرژی در قرن بیست و یکم
- چشمه زائربرون
- چشمه سالسبرون
- چشمه مارین باد
- چشمه هارتس
- چشمه های آرسنیک
- چشمه های انیدرید کربنیک
- چشمه های تلخ
- چشمه های سولفات سدیم دار
- چشمه های قلیایی
- چشمه های گوگردی
- چشمه های معدنی آهن دار
- چشمه های معدنی تلخ
- چشمه های معدنی سولفات سدیم
- چشمه های معدنی کلرور سدیم
- چشمه های ید دار
- چشمه وویشی
- چغندر
- چغندر قند
- چگال ترین فلزات
- چگالی
- چگالی اورانیم
- چگالی اوسمیم
- چگالی پالادیم
- چگالی پلاتین
- چگالی پلوتونیوم
- چگالی تنگستن
- چگالی جیوه
- چگالی دی اکسید گوگرد
- چگالی سرب
- چگالی سنج
- چگالی سولفوریک اسید
- چگالی طلا
- چگالی عناصر جدول تناوبی
- چگالی نسبی
- چگالی نقره
- چگالی هیدروژن سولفید
- چگونه آب معدنی بسازیم
- چگونه اتانول درست کنیم
- چگونه اثر انگشت را ظاهر کنیم
- چگونه بهتر متون شیمی را ترجمه کنیم
- چگونه روی سولفید و روی کربنات را از هم تشخیص دهیم
- چگونه روی کربنات و منیزیم کربنات را از هم تشخیص دهیم
- چگونه شیمی را بیاموزیم
- چگونه عناصر تشکیل شدند
- چگونه غلظت اتانول را اندازه بگیریم
- چگونه غلظت الکل را اندازه بگیریم
- چگونه غلظت سولفوریک اسید را بفهمیم
- چگونه لحیم کاری کنیم
- چگونه منیزیم اکسید و روی اکسید را با استفاده از محلول سدیم هیدرو اکسید شناسایی کنیم
- چگونه یون روی را از دیگر یون ها شناسایی کنیم
- چند عدد از عناصر جدول تناوبی در طبیعت وجود دارند
- چند نوع آب از نظر ایزوتوپی داریم
- چهار راه برای نابود کردن کروناویروس
- چهار عمل اصلی شیمی
- چهار نیروی اساسی در طبیعت
- چیلر جذبی
- حا مسائل شیمی یازدهم
- حاصلضرب حلالیت Ksp
- حالت چهارم مواد
- حامد چناری
- حدیث دبیری نژاد
- حدیث ساغری زاده
- حدیث منصوری
- حدیث نوع نواز
- حسگر هیدروژن
- حسن توکلی دبیر شیمی
- حسن توکلی هرندی
- حسن حسنی مطلق
- حسن مدرک
- حسن مدرک دبیر شیمی
- حسنا منفرد
- حسین اکرامی
- حسین رحمتی
- حسین رحمتی پاورپوینت شیمی
- حسین شاهزیدی
- حفاظت از محیط زیست
- حفره زایی
- حقایق بلورها
- حقایق جالب اسید و باز
- حقایق جالب در مورد نمک ها و صابون ها
- حقایق جالب درباره طلا
- حقایق جالب طلا
- حقایق جدول تناوبی
- حقایق زر
- حقایق سیلیسیم
- حقایق شیمی
- حقایق شیمی (عناصر)
- حقایق شیمی ۳ (فلزات)
- حقایق شیمی آلی
- حقایق شیمی اسید و باز
- حقایق شیمی درباره اسید و باز
- حقایق شیمی درباره ی اسید و باز
- حقایق شیمی-بوراکس
- حقایق شیمی: شیمی آلی
- حقایق شیمی: فلزها
- حقایق شیمی(عناصر)
- حقایق طلا
- حقایق عناصر
- حقایق فلزات
- حقایق فلزها
- حقایق کلسیم
- حقایق نیتروژن
- حل المسائل شیمی دهم
- حل تمرین های شیمی دهم
- حل تمرین های شیمی یازدهم
- حل شونده
- حل مسائل به روش استوکیومتری و از روش تناسب کنکوری
- حل مسائل شیمی با استوکیومتری
- حل مسائل شیمی با تناسب
- حل مسائل شیمی دهم
- حلال برای الیاف
- حلالیت گوگرد
- حلالیت گوگرد در آب
- حلالیت نمک ها
- حلقه بنزن
- حلقه های آروماتیک
- حمل و نقل
- حمل و نقل هیدروژن
- حمل و نقل و نگهداری مواد شیمیایی
- حمید رضا سمویی
- حمید کاظمی حکی
- حمیدرضا سمویی
- حنانه سفید دشتی
- حنانه کوچکی
- خاصیت احیاکنندگی گاز گوگرد دی اکسید
- خاصیت اکسیدکنندگی گاز گوگرد دی اکسید
- خاصیت اکسیدکنندگی گوگرد تری اکسید
- خاصیت رنگبری سولفورو اسید
- خاصیت رنگبری گاز گوگرد دی اکسید
- خاصیت های فلزات نجیب
- خاکستر
- خاکستر دگازور
- خاکه
- خاکه زغال
- خاکه شکر
- خالص سازی فلز
- خانم فرزانه قاسمی
- خانم نرجس زارعی
- خانه آپارتمانی خودکفا
- خانه پیل سوختی
- خانه تکانی
- خانه تمیزتر با آب اکسیژنه
- خدیجه خارستانی
- خرید از کیان دروید
- خرید پایان نامه
- خرید پایان نامه شیمی
- خرید رنگ های پیگمنت
- خرید و فروش پایان نامه
- خشک کردن تخم مرغ
- خشک کردن جامدات اصول و کاربردها
- خشک کن
- خصوصیات و ویژگی های برلیوم
- خطای انسانی در صنایع فرایندی
- خطرات اسید سیا نیدریک و ترکیبات آن
- خطوط هوایی
- خلاء
- خلال چغندر
- خنثی
- خواص آب معدنی های اسیدی
- خواص آب های آهن دار
- خواص آب های اسیدی
- خواص آب های گوگردی
- خواص چشمه های آرسنیک
- خواص چشمه های سولفات سدیم
- خواص چشمه های قلیایی
- خواص چشمه های گوگردی
- خواص چشمه های معدنی آهن دار
- خواص چشمه های معدنی تلخ
- خواص چشمه های معدنی سولفات سدیم
- خواص چشمه های معدنی سولفات سدیم دار
- خواص چشمه های معدنی قلیایی
- خواص چشمه های معدنی کلرور سدیم
- خواص چشمه های ید دار
- خواص شیمیایی سلنیوم و تلور
- خواص شیمیایی سولفوریک اسید
- خواص شیمیایی گوگرد
- خواص شیمیایی گوگرد تری اکسید
- خواص شیمیایی گوگرد دی اکسید
- خواص شیمیایی منو اکسید گوگرد
- خواص شیمیایی هیدروژن سولفید
- خواص فیزیکی سولفوریک اسید
- خواص فیزیکی گوگرد
- خواص گاز کلر
- خودرابیازمایید
- خودروهای الکتریکی
- خودروهای هیدروژنی
- خورشید و گداخت هسته ای
- دئودورانت ارزان
- داتیو
- دارماستادیوم
- دارو
- داروی ثبوت
- داریوش مهجوری
- داستان پیوند داتیو
- داستان پیوند کووالانسی
- داستان پیوند یونی، الکترو استاتیک
- داستان ساختار گوگرد دی اکسید
- داستان شیرین قند
- داستان های شیمی
- دانش آموزان دهم
- دانشگاه تاجیکستان
- دانشگاه شفیلد
- دانشگاه نفت و گاز
- دانشگاه وارویک
- دانلود جزوه شیمی دهم
- دانیال حسنوند
- دانیال حسنوندپور
- دبی
- دبی جرمی
- دبیر شیمی آنلاین
- دبیر شیمی اصفهان
- دبیر شیمی حضوری اصفهان
- دبیرخانه راهبری صنایع شیمیایی
- دبیرخانه راهبری کشوری صنایع شیمیایی
- دبیرخانه صنایع شیمیایی
- دبیرستان امام علی اصفهان
- دبیرستان بانو امین
- دبیرستان شهیدان احسانی
- دبیرستان فردوس
- دبیرستان نمونه کوثر آق قلا
- دبیرستان نیرومند
- درآمد با تولید محتوی
- درباره گوگرد
- درجات اکسایش گوگرد
- درجات اکسیداسیون گوگرد
- درجه اکسایش عناصر
- درجه اکسایش گوگرد در سولفات
- درجه اکسایش گوگرد در سولفیت
- درجه بومه
- درجه تفکیک
- درجه خلوص
- درجه و درصد تفکیک
- درس پژوهی شیمی
- درس شیمی
- درسا جزینی
- درصد
- درصد اکریلیک ابریشم
- درصد اکریلیک پشم
- درصد اکریلیک پلی استر
- درصد اکریلیک پنبه
- درصد پلی استر پشم
- درصد پلی استر ویسکوز
- درصد تبخیر
- درصد حجمی حجمی
- درصد حجمی وزنی
- درصد قند
- درصد قند شیره انگور
- درصد قند شیره خرما
- درصد قند شیره سیب
- درصد قند شیره میوه جات
- درصد قند میوه جات
- درصد وزنی حجمی
- درصد وزنی وزنی
- درمان خستگی و بیماری های روانی
- درمان عفونت باآب اکسیژنه
- درمان قارچ پا باآب اکسیژنه
- درمان کورک باآب اکسیژنه
- درمان میخچه و پینه باآب اکسیژنه
- درمان های پوستی
- دریافت فایل گویش درست شیمی تخصصی
- دزیدراتاسیون
- دستگاه بیت المللی
- دستگاه تصفیه آب
- دستگاه دیفوزیون
- دستگاه رفراکتومتر
- دستگاه عصاره گیر
- دستگاه کیپ
- دستگاه های کاهش اندازه مواد
- دستگاه های واحدها
- دستور العمل روش پاششی رنگ فانتا کروم
- دستور بشام
- دفکاسیون
- دکانتور
- دکتر ابوالحسن شیخ
- دکتر حسن متقی
- دکتر حمید رضا سمویی
- دکتر سمویی
- دکتر گوهر دیلمی راد
- دکتر مائده کوهی
- دکتر محسن زمانی
- دکتر محمد تقی کوثر نشان
- دکتر محمد یوسفی
- دکتر محمود بیگلری
- دکتر معصومه چمک
- دکتر مهدی اسحاقی
- دکترشهره نفیسی
- دکترشهره نفیسی دکترای شیمی معدنی
- دکسترومتورفان
- دما و دماسنج
- دما و یکا های اندازه گیری آن
- دماسنج گالیم
- دناتوره
- دنیا میرزایی
- ده تا از زیبا ترین کانی ها
- ده تا از زیبا ترین کانی های معدنی دنیا
- ده واکنش شیمیایی مهم
- دهان شوی گند زدا آب اکسیژنه
- دهمین کنفرانس آموزش شیمی ایران
- دو آزمایش بر روی آب چغندر
- دو آلکیل وآریل سولفونیک اسید
- دوای ثبوت
- دوبنیوم
- دود نشادر
- دودزا
- دوره
- دوره طیف نگاری
- دومین سالگرد روز مول ایرانی
- دویلین
- دی ازوتاسیون
- دی اکسید گوگرد
- دی تیونو اسید
- دی تیونیت سدیم
- دی تیونیت ها
- دی تیونیت های قلیائی
- دی تیونیت های قلیایی
- دی فنیل اوره
- دی کلسیم فسفات
- دی گوگرد دی کلرید
- دی متیل آنیلین
- دی نیتروژن اکسید
- دی متیل آمینوپروپیل آمین
- دیانا عبداله زاده
- دیزل تجدیدپذیر
- دیسپروزیوم
- دیفوزیون
- دیکشنری شیمی آنلاین
- دیود
- ذخیره هیدروژن
- ذرات تشکیل دهنده اتم
- ذغال
- ذوب گوگرد
- رابطه چگالی و غلظت
- رابطه غلظت گرم بر لیتر با مولاریته
- رابطه غلظت گرم بر لیتر با نرمالیته
- رابطه لیتر اتمسفر و ژول
- رابطه میان شیمی و الکترونیک
- رابطه ی شیمی با دیگر دانش ها
- رابطه ی شیمی با دیگر علوم
- رادرفوردیوم
- رادیوایزوتوپ
- رادیولیز
- راضیه منصوری
- راکتور هضم
- راکتورهای شیمیایی
- رانیا دریس پور
- رانیفارم
- راهنمای خرید از مارکت کیان دروید
- راهنمای شیمی دهم
- رتینوئیدهای موضعی
- رحیم زینالی
- رده بندی طیفی ستارگان
- رزومه رویا ایازی نصر آبادی
- رزومه رویا ایازی نصرآبادی
- رزومه شیمی
- رزومه شیمی آلی
- رزومه شیمی تجزیه
- رزومه شیمی فیزیک
- رزومه شیمی کاربردی
- رزومه شیمی معدنی
- رزومه های آموزش شیمی
- رزومه های شیمی
- رزومه های شیمی آلی
- رزومه های شیمی پلیمر
- رزومه های شیمی پیشرانه ها
- رزومه های شیمی دارویی
- رزومه های شیمی دریایی
- رزومه های شیمی فناوری اسانس
- رزومه های شیمی فیزیک
- رزومه های شیمی کاتالیست
- رزومه های شیمی معدنی
- رزومه های شیمی نفت
- رزومه های شیمی و مهندسی شیمی
- رزومه های صنایع شیمیایی
- رزومه های فیتوشیمی
- رزومه های مهندسی شیمی
- رزومه های نانوشیمی
- رزونانس
- رزین
- رژ لب
- رژلب
- رسم ساختار گوگرد دی اکسید
- رسم ساختارلوئیس
- رسم ساختارلوئیس شیمی دبیرستان
- رسم ساختارلوئیس شیمی دهم
- رسوب سنجی
- رسوب های یون روی و رنگ آنها
- رسیدن به پی اچ مورد نظر
- رشته صنایع شیمیایی
- رشته صنایع شیمیایی هنرستان
- رشد بلور نمک آلومینیم
- رضا ثاقب پور
- رضا خدری
- رضا زمانی
- رضا عابدی
- رضا عابدی قانون بویل
- رضا فتح اللهی
- رضا نصیری
- رطوبت زدایی
- رفراکتومتر
- رفراکتومتر آنلاین
- رقابت تولید آمونیاک در آزمایشگاه
- رقیق کردن
- رقیه خلفی
- رقیه مسگر
- رنگ
- رنگ بری مو با آب اکسیژنه
- رنگ ترکیبات منگنز در حالات اکسایش مختلف
- رنگ دانه
- رنگ دایلون
- رنگ راکتیو
- رنگ راکتیو سرد
- رنگ راکتیو گرم
- رنگ زا ها برا پلی آمیدها و پروتیین ها
- رنگ زا ها برای پلیمر های سلولزی
- رنگ زا ها برای پلیمر های کاتیونی
- رنگ عناصر جدول تناوبی
- رنگ فانتا کروم
- رنگ کروم
- رنگ گوگرد رومبیک
- رنگ مستقیم
- رنگ هـای پـودری
- رنگ های پودری الکترواستاتیک
- رنگ های تست شعله (پوستر)
- رنگ های جوهری
- رنگ های خوراکی
- رنگ های دایلون چند منظوره
- رنگ های یون های فلزات واسطه
- رنگدانه های معدنی
- رنگرزی
- رنگرزی پارچه پنبه ای
- رنگرزی پارچه پنبه ای با رنگ ثابت
- رنگرزی پارچه پنبه ای با رنگ راکتیو
- رنگرزی پشم یا ابریشم یا نایلون با متیل اورانژ
- رنگرزی پلی کروماتیک
- رنگرزی خمی
- رنگرزی در خانه
- رنگرزی در ماشین جت
- رنگرزی سرد
- رنگرزی گرم
- رنگرزی مستقیم روی پنبه
- رنگرزی و چاپ خمی
- رنگهـای پـودری
- رنو
- روابط رقیق کردن در شیمی
- روبیدیم
- روتا متر
- روتنیم
- روح الله ساول زاده
- روح الله فتح اللهی
- رودازین دی
- رودوکروزیت
- رودیم
- روز مول
- روز مول ایرانی
- روژین محمدی
- روژینا حیاتی
- روسیه
- روش آزمایشگاهی تهیه گوگرد دی اکسید
- روش استخراج آنیلین
- روش استخراج آنیلین با اتر
- روش استخراج آنیلین با کلرفرم
- روش استوکیومتری در حل مسائل شیمی
- روش انجام آزمایش رونگه
- روش براق کردن طلا
- روش براق کردن کروم
- روش بشام برای ساخت آنیلین
- روش پاک کردن انواع فلزات
- روش تشخیص سلنیوم و تلور
- روش تناسب در حل مسائل شیمی
- روش تهیه سدیم سولفات
- روش تهیه صابون جامد
- روش تهیه قند
- روش تیتراسیون برای تعیین غلظت محلول نقره نیترات
- روش دی ازوتاسیون
- روش ساخت آنیلین
- روش ساخت آنیلین از طریق کاهش ترکیبات نیترو
- روش ساخت آنیلین با آهن
- روش ساخت آنیلین با قلع
- روش ساخت گاز اتان از هیدورلیز منیزیم اتیل برمید
- روش ساختن الکل طبی
- روش سفید کردن چرم
- روش سفید کردن نقره
- روش صنعتی تهیه دی اکسید گوگرد استفاده از سوزاندن گوگرد
- روش صنعتی تهیه گوگرد دی اکسید
- روش فراش
- روش های پاک کردن اجسام
- روش های تصفیه آب
- روش های تهیه سولفید ئیدروژن
- روش های تهیه گاز گوگرد دی اکسید
- روش های تهیه هیدروژن سولفید
- روغن زاج کلریدریک اسید
- روغن ها و چربی ها
- رونتگنیوم
- رونگالیت
- رونگالیت چیست
- رونمایی شرکت خودروسازی رنو از اولین مدل خودروی هیدروژنی
- روی
- روی سولفید
- روی کربنات
- روی مس قلع
- رویا ایازی دکتری شیمی آلی
- رویا ایازی نصرآبادی
- رویا ایازی نصرآبادی دکتری شیمی آلی
- رویا حیدری
- رویین شدن
- ری گیری طلا
- ریحانه آذردار
- ریحانه بویه
- ریحانه پیرحیاتی
- ریحانه تمدنی
- ریحانه حاضر
- ریحانه فتح آبادی
- ریحانه مارزی
- ریخته گری با گوگرد
- ریژسیون
- ریگری طلا
- زاج سبز آمونیم کلرید
- زاج سپید و جوش شیرین
- زاج سفید آلومینیم پتاسیم سیلیکات
- زاویه پیوندی
- زاویه پیوندی نام گذاری: ترکیبات یونی و کووالانسی استوکیومتری: تعریف مول
- زر
- زرد چوبه
- زردچوبه
- زرده
- زعفران
- زغال
- زغال چوب
- زغال سنگ
- زکیه باهری
- زنگ زدگی آهن
- زنون
- زهرا آقامیری
- زهرا آقامیری پاورپوینت شیمی
- زهرا ابراهیم خانی
- زهرا احمدی
- زهرا اکربلیوند
- زهرا اوجی
- زهرا حدادی
- زهرا حیدری
- زهرا داوری
- زهرا دینی زاده
- زهرا رمضانی
- زهرا روشنی
- زهرا زارعی
- زهرا زمانی
- زهرا سادات
- زهرا سادات شاهزیدی
- زهرا شعبانپور
- زهرا صادقی
- زهرا صریح زاده
- زهرا فراهانی
- زهرا کاویانی
- زهرا کاویانی مفرد
- زهرا کرامتی
- زهرا کریم زاده
- زهرا کشاورز
- زهرا محبی
- زهرا محمدلو
- زهرا مرادیان
- زهرا معروفی
- زهرا مولا زاده
- زهرا(ماه بانو) سادات
- زهراآقاخانی
- زهرامرادیان
- زیبا عظیمی
- زیبایی پوست
- زیر ساخت شارژ خودرو
- زیرکونیوم
- زینب حیدری
- زینب سادات لطیفی
- زینب سبز علی
- زینب صالحی
- زینب نصیری
- زینب نظری
- زینک اکساید
- ژاپن
- ژاپن موتور هیدروژنی نسل بعدی هواپیما
- ژاروسیت
- ژرمانیوم
- ژنتیانا
- ژنتیانا وبولت
- ژیپس کلسیم کربنات
- ساتراسیون
- ساحل نصرتی
- ساخت آنیلین
- ساخت آنیلین با آهن
- ساخت آنیلین با قلع
- ساخت آنیلین با نیتروبنزن
- ساخت آنیلین به روش کاهش ترکیبات نیترو
- ساخت اتان از هیدرولیز منیزیم اتیل برمید
- ساخت اتانول
- ساخت اتر خشک
- ساخت اتر مطلق
- ساخت اسپکتروسکوپ ساده
- ساخت الکل
- ساخت الکل در خانه
- ساخت باتری
- ساخت بورت اتوماتیک با آردوینو
- ساخت پی اچ متر با آردوینو
- ساخت ترموستات
- ساخت دماسنج با آردوینو
- ساخت رژ لب
- ساخت رنگ کروم
- ساخت سولفوریک اسید ۶۰ درصد
- ساخت شمع
- ساخت شمع تزئینی
- ساخت طیف نمای ساده
- ساخت فشار سنج با آردوینو
- ساخت کاغذ تشیص گاز کلر
- ساخت گاز اتان
- ساخت گاز اتان از هیدرولیز منیزیم اتیل برمید
- ساخت گاز خانگی کم هزینه
- ساخت گاز متان
- ساخت گاز متان با چوب
- ساخت گاز متان با سدیم استات
- ساختار الماس
- ساختار رزونانس
- ساختار شیمیایی ویتامین ها
- ساختار گوگرد دی اکسید
- ساختار لوویس ویژه کنکور و المپیاد شیمی
- ساختار لوییس
- ساختارهای رزونانس
- ساختمان الکترونی گوگرد
- سارا امیری زاده
- سارا بحرانی
- سارا توکلی مطلق
- سارا خوش نژاد
- سارا شاطر آبادی
- سارا فرهانیان مقدم
- سارا فرهانیان مقدم کارشناس ارشد شیمی معدنی
- سارا فلاحی
- سارا کلاه کج
- سارا ورپایی
- سارا یوسفی
- ساراواک
- ساکارز
- ساکارومات
- ساکارومتر
- سالیسیلات
- سالیسیلیک اسید
- سام قلی پور
- ساماریوم
- سامان جوزق کار
- سان ست یلو
- ساناز افخمی
- سایت آموزش شیمی
- سایت شیمی
- سایت های مفید شیمی
- سایت همه ی واکنش ها
- سبحان زمانی
- سپسد کردن ناخن باآب اکسیژنه
- سپیدگری با گاز کلر
- سپیدگری با گوگرد دی اکسید
- سپیده گراوندی
- ستاره شناسی
- ستاره موسوی
- ستاره های کم جرم در حال مرگ
- ستاره هیبتی
- ستایش ابراهیمی
- ستایش استاد
- ستایش افشار پور
- ستایش حفذه
- ستایش حکیم نیا
- سجاد سوبرانی
- سجاد ممتاز
- سحابی ها، عناصر و رنگ ها
- سحر درخشان
- سحر عبدالخانی
- سختی
- سختی آب جوشیده کمتر است یا آب یخ زده؟
- سختی عناصر جدول تناوبی
- سدسم سیلیکات
- سدسم هیدرواکسید
- سدیم
- سدیم آزید
- سدیم آلومینیم فلئورید
- سدیم برات
- سدیم بی کربنات
- سدیم پلی سولفاید
- سدیم پلی سولفید
- سدیم پیروات
- سدیم تیوسولفات
- سدیم تیوسیانات
- سدیم دی کرومات
- سدیم سولفات
- سدیم کربنات
- سدیم کرومات
- سدیم کلرید
- سدیم لوریل اتر سولفات
- سدیم نیترات
- سدیم نیتریت
- سدیم نیترید
- سدیم هیپوکلریت
- سدیم هیدرو اکسید
- سدیم هیدرواکسید
- سدیم هیدروژن کربنات
- سر بخار
- سرب استات
- سرب تترا اکسید
- سرب سرخ
- سرب سفید
- سرب سیاه
- سرب کربنات بازی
- سرب منواکسید
- سرب نیترات
- سرب یدید
- سرب(II) کرومات
- سرعت های گوناگون در واکنش های شیمیایی
- سرعت واکنش های شیمیایی
- سرکار خانم مریم کریمیان
- سرگرمی های شیمی
- سرور معیدی
- سرویس و نگهداری تجهیزات
- سری الکتروشیمیایی
- سری واکنش پذیری فلزات
- سری واکنش پذیری فلزات بر اساس علوم نهم
- سریم
- سزکوئی اکسید گوگرد
- سزیم
- سطح سنج نقطه ای
- سفرهای هوایی
- سفید آب روی
- سفید آب روی روی سولفات
- سفید آب کف
- سفید کردن برنج
- سفید کردن دندان با خمیردندان هیدروژن پر اکسید آب اکسیژنه
- سفید کردن سنگ مرمر
- سفید کردن طلا
- سفید کردن قلع
- سفید کردن کروم
- سفید کردن لینولیوم
- سفید کردن مرمر
- سفید کردن مس
- سفیدگری با گاز کلر
- سفیده
- سفیده تخم مرغ
- سقید آب کف
- سکینه ایزدپناه
- سل های خورشیدی(پاورپوینت)
- سلامتی و زیبایی با آب اکسیژنه
- سلایت
- سلماز حیدریان
- سلنیوم
- سلنیوم Selenum – تلور Tellur
- سلنیوم بی شکل
- سلنیوم خاکستری
- سلنیوم شیشه ای
- سلنیوم قرمز
- سلهای الکتروشیمیایی منتشر کننده نور
- سلهای فوتوولتائیک
- سما محرمی
- سمانه زارعی
- سمیرا داتلی بیگی
- سمیه باقری
- سمیه عاقریان
- سمیه غلامی شیمی معدنی
- سمیه غلامی کارشناس ارشد شیمی معدنی
- سنتز آمونیاک
- سنتز استر
- سنتز اسید سولفوریک
- سنتز عناصر سنگین تر از اورانیوم
- سنتز فنیل هیدروکسیل آمین
- سنتز گرافن با استفاده از روش سولوترمال
- سنتز متیل اورانژ
- سنتز متیل نارنجی
- سنجش حجمی
- سنجش های حجمی
- سنگ آهک منیزیم هیدرواکسید
- سنگ جهنم
- سنگ گچ
- سنگ لیدی
- سنگ محک
- سنگ های معدنی گوگرد
- سنگ های معدنی گوگرد دار
- سه روش برای پیدا کردن واکنش دهنده محدود کننده، محصول تئوری
- سواستات
- سوالات کاربردی
- سوالات کنکور شیمی
- سوبلیمه
- سوپر کیلر دوجزیی
- سوخت پیل سوختی
- سوخت جت
- سوخت های دریایی
- سوخت های فسیلی
- سوخت های مایع و جامد راکت ها
- سوخت هواپیما
- سوخت هیدروژن
- سوختن آلومینیم
- سوختن اتیلن در گاز کلر
- سوختن باروت
- سوختن پیریت
- سوختن شمع در گاز کلر
- سوختن هیدروژن سولفید
- سوختن هیدروژن سولفید در اکسیژن
- سود پرک
- سود پرک اصفهان
- سود پرک خوراکی
- سود پرک کلران
- سود پرک نیرو کلر
- سود سوز آور
- سود سوزآور
- سودپرک به جای شامپو و پودر شوینده
- سورفکتانت
- سوسن ضرابی
- سوگند اسدی
- سولفات آهن
- سولفات جیوه
- سولفات کلسیم
- سولفات مضاعف آلومینیم و پتاسیم
- سولفات نقره
- سولفات ها
- سولفات های محلول
- سولفات های نا ملحلول
- سولفاناسیون
- سولفور
- سولفور کربن
- سولفورو آهن (III)
- سولفورو اسید
- سولفورو اسید بسازید
- سولفوریک اسید
- سولفوکسیلیک اسید
- سولفونیک اسید
- سولفید ئیدروژن
- سولفید کربن
- سولفید مس
- سولفید نیتروژن
- سولماز حیدریان
- سونولومینسانس
- سیانید های آلی
- سیانید هیدروژن
- سیبورگیوم
- سیتریک اسید
- سید آرمان عابدی
- سید ارتوسولفوریک
- سید اسمائیل فضل جو
- سید اسماعیل فضل جو
- سید امیر حسین موسوی
- سید امیرحسین موسوی
- سید سعید حسینی
- سید علیرضا رضوی
- سید محمد رستگار
- سید مهدی خوش فطرت
- سیدحسن ناصری
- سیده آیدا هاشمی
- سیده پریا طاهریان
- سیده سارا بخشایش
- سیستم
- سیستم بین المللی
- سیستم خنک کاری در داخل پیل سوختی
- سیستم گرمایش
- سیستم های اندازه گیری
- سیستم هوا در داخل پیل سوختی
- سیستم هیدروژن در داخل پیل سوختی
- سیلر
- سیلندرهای گاز فشرده
- سیلوری
- سیلیس آبدار بی شکل
- سیلیسیک اسید بسازید
- سیلیسیک اسید یک اسید ضعیف
- سیلیسیم
- سیلیسیم آموروف
- سیلیسیم دی اکسید
- سیلیسیم دی اکسید بسازید
- سیلیسیم دی سولفید
- سیلیکات ها را بسازید
- سیلیکون کاربید
- سیم آب
- سیم تینل
- سیم تینول
- سیمین زمانی
- سینتیک شیمیایی
- شادی خاوری
- شادی عباسی منجزی
- شارژ خودرو
- شایان بابادی
- شایان محمدوند
- شایان مهری دهنو
- شایسته دینه کبودی
- شباهت قلیایی ها و بازها
- شبرنگ
- شبه فلز
- شبه فلزات
- شبیه ساز طیف نگاری
- شبیه ساز های نور و طیف نگاری
- شراره طاهری
- شرایط استاندارد
- شرایط استاندارد استوکیومتری واکنش دهنده ها
- شرایط انتشار در کیمیکال
- شربت استاندارد
- شربت خام
- شربت رفوند
- شربت رقیق
- شربت غلیظ
- شرح اسپاترینگ
- شرکت پرک بندر امام
- شرکت صدرا شیمی
- شرکت فورد
- شستشوی یخچال و فریزر
- شستن کاسه توالت باآب اکسیژنه
- شستن میوه و سبزی
- شش روش طبیعی برای کشتن موریانه
- شعاع کووالانسی
- شقایق دوست پرور
- شقایق سنجیده
- شقایق سنگ کشها
- شکر
- شکر سرب
- شکرخام
- شکست سنج
- شکل بلور هشت وجهی گوگرد
- شکل فضایی
- شکن گیری طلا
- شکوفه شبانکاره
- شکیبا داودی
- شماتیک فرآیند
- شمسی شاه کرم
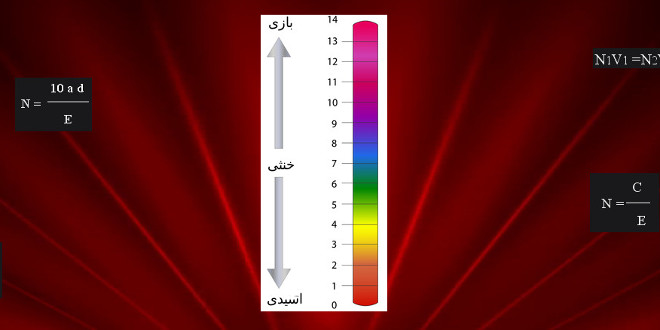
- شناساگر اسید و باز
- شناساگر یونیورسال
- شناساگر یونیورسال (پوستر)
- شناساگرهای آزمایشگاهی
- شناسایی روی کلرید و سدیم کلرید
- شناسایی سالیسیلیک اسید آزاد در آسپیرین
- شناسایی عناصر
- شناسایی یون روی
- شناسایی یون روی- تجزیه کیفی
- شنگرف
- شهاب نوشمند
- شهاب نوشمند کارشناسی ارشد مکانیک
- شهاب نوشمند کارشناسی ارشد مکانیک تبدبل انرژی
- شهاب نووشمند
- شهره فردادوند
- شهره فردادوند اقدام پژوهی
- شهره فردادوند پاورپوینت شیمی
- شهره فردادوند دبیر شیمی
- شهره فردادوند علل افت تحصیلی
- شهره فردادوند مقاله مدارس هوشمند
- شهره نفیسی
- شوره خاک
- شوره قلمی
- شوره مذاب
- شولاژ
- شیدا آمدی
- شیدا فلاح
- شیر آهک
- شیر تخلیه
- شیرآهک
- شیرمنیزی منیزیم سولفات
- شیشه
- شیشه ابزار
- شیشه الات
- شیما حمداوی
- شیما خیر بخش
- شیما قنواتی
- شیمی
- شیمی آشپزخانه
- شیمی آلی
- شیمی آلی پایه تلگرام
- شیمی آلی تلگرام
- شیمی آلی چیست؟
- شیمی آلی فلزی
- شیمی باروت
- شیمی باروت سیاه
- شیمی برای بچه ها
- شیمی برای عموم
- شیمی برای کودکان
- شیمی برای کودکان و نوجوانان
- شیمی پایه
- شیمی پیش دانشگاهی
- شیمی تجزیه
- شیمی تجزیه تلگرام
- شیمی تجزیه کلاسیک
- شیمی تجزیه و کمومتریکس
- شیمی ترکیبات گوگرد
- شیمی تلور
- شیمی دانشگاهی
- شیمی دبیرستان
- شیمی در آشپزخانه
- شیمی دهم
- شیمی دهم انواع آب از نظر جرم مولکولی
- شیمی دهم مول
- شیمی دوازدهم
- شیمی رنگ
- شیمی رنگ ها
- شیمی رنگ های پاییزی
- شیمی سال دهم
- شیمی سطح داریوش مهجوری تلگرام
- شیمی سلنیوم
- شیمی سولفوریک اسید
- شیمی شیشه
- شیمی شیشه رنگی
- شیمی شیشه های رنگی
- شیمی صنعت تلگرام
- شیمی عمومی
- شیمی غلظت ها
- شیمی فشفشه ها
- شیمی فشفشه ها (پوستر)
- شیمی فلزات
- شیمی فیزیک تلگرام
- شیمی کالج های انگلستان
- شیمی کیسه هوا
- شیمی کیسه ی هوا
- شیمی کیهان چیست
- شیمی گوگرد
- شیمی محاسباتی تلگرام
- شیمی محاسباتی علی اسماعیلی
- شیمی محلول ها
- شیمی معدنی
- شیمی معدنی تقارن
- شیمی معدنی تلگرام
- شیمی مواد آتش بازی
- شیمی میان ستاره ای
- شیمی نساجی
- شیمی هناصر
- شیمی هندوانه
- شیمی هیدروژن سولفید
- شیمی و سرگرمی
- شیمی یازداهم
- شیمی یازدهم
- شیمی یازدهم کاوش کنید
- شیمی یازدهم گرما
- شیمیلومینسانس
- شیوهای سنتی عیار سنجی طلا و نقره
- صابر رشتاک
- صابون
- صابون ها شیمی دوازدهم
- صابون ها و نمک ها
- صابون های سفید
- صادرات انرژی
- صبا بیدکی
- صبا رحیمی
- صبا سیروس
- صفات گاز اتیلن
- صنایع شیمی
- صنایع شیمیایی
- صنعت شیمی
- صنعت گوگرد
- ضد بو
- ضد عرق
- ضد عرق ارزان
- ضد عفونی اپن باآب اکسیژنه
- ضد عفونی ارزان برای کرونا
- ضد عفونی اسفنج ظرف شویی
- ضد عفونی جراحت های کوچک با آب اکسیژنه
- ضد عفونی کردن
- ضد عفونی مسواک باآب اکسیژنه
- ضدبو
- ضدعفونی زخم با آب اکسیژنه
- ضریب شکست
- طئیب شاه علیزاده
- طبقه بندی تناوبی عناصر
- طبقه بندی رنگینه ها
- طبقه بندی مولکول ها
- طراحی و ساخت سازه های کامپوزیتی
- طرح درس شیمی
- طرح درس های شیمی
- طرز تعیین چگالی نسبی بنزن
- طرز تهیه سرکه انگور
- طرز تهیه سرکه با چند میوه
- طرز تهیه سرکه سیب
- طرز تهیه محلول ضدعفونی کننده دست خانگی
- طرز تهیه ی سلنیوم و تلور
- طریق ساخت رنگ فانتا کروم
- طریقه از بین بردن رسوبات سماور
- طریقه از بین بردن گچ سماور
- طریقه انگشت نگاری پلیس
- طریقه براق کردن نقره
- طریقه پاک کردن زغال از شیشه
- طریقه پاک کردن سنگ دیگ
- طریقه ساخت آب معدنی
- طریقه ساخت آنیلین
- طریقه ساخت رنگ فانتاکروم
- طریقه ساخت سوخت موشک آنیلین
- طریقه ساختن آنیلین در آزمایشگاه
- طریقه سفید کردن نقره
- طریقه ظاهر کردن اثر انگشت
- طلا
- طلا چگونه کشف شد
- طلا و فلزات بازیافتی به فلز اولیه با درجه خلوص بالا
- طلا(III)کلرید
- طلای سپید
- طلای سفید
- طلای سیاه
- طناز ملکی پور
- طهورا بیک پور
- طول پیوند
- طول موج
- طیف
- طیف جذبی
- طیف رادیویی
- طیف سنجی الکترونی
- طیف سنجی رامان
- طیف عناصر شیمی دهم
- طیف نشری
- طیف نشری اتم هیدروژن
- طیف نشری خطی اتم هیدروژن
- طیف نگاری
- طیف نگاری شیمی
- طیف نگاری شیمی دهم
- طیف نمایی
- طیفسنجی رزونانس مغناطیسی هسته
- طیفسنجی فوتوالکترون پرتو ایکس
- طیفسنجی مادون قرمز
- طیفسنجی مرئی-ماورابنفش
- طیفهای جذب و نشر اتمی
- ظاهر کردن اثر انگشت با آلومینیوم
- ظاهر کردن اثر انگشت با مرکب
- ظاهر کردن اثر انگشت با ید
- ظاهر کردن اثر انگشت در قدیم
- ظرفیت
- عارفه پنیریان
- عارفه خدایی
- عامل متیل
- عامل نیترو
- عبدالله عابدی
- عبدالهی
- عدد آوگادرو
- عدد آووگادرو
- عدد اتمی
- عدد اکسایش
- عدد اکسایش cr2o5
- عدد اکسایش پر اکسی دی سولفوریک اسید
- عدد اکسایش پرمنوسولفوریک اسید
- عدد اکسایش در برخی ترکیبات ویژه
- عدد اکسایش هیدروژن
- عدد جرمی
- عرفان حیدری مهذب
- عسل حسینی
- عسل ستاری نژاد
- عسل محبی
- عطیه بهرامیان
- عطیه خزاعی
- علائم انجام یک واکنش شیمیایی
- علت سبک شدن تخم مرغ کهنه
- علوم نهم
- علوم نهم پلی اتن
- علوم هشتم
- علی اسماعیلی
- علی اصغر علویان
- علی اصغر علیجانی
- علی بحیرایی
- علی جعفری
- علی جلیلیان
- علی جلیلیان آرایش الکترونی
- علی جوانمردی
- علی حیدری
- علی حیدری سیچانی
- علی دری برنجگانی
- علی رنجبر
- علی شهبازی
- علی شیرازی
- علی صفدریان
- علی عسگری
- علی لطفی
- علی لنگرمراد
- علی محمدی
- علی محمدیان
- علی نیک خو
- علی نیکخو
- علی یادگاری
- علیرضا خسروی
- علیرضا رییسی
- علیرضا شرفی
- علیرضا شیر احمد
- علیرضا کونجانی
- علیرضا کیانی دوست
- علیرضاحسینی
- عماد صابریان
- عمان
- عملیات تولید شکر از چغندر قند
- عملیات دستگاهی
- عملیات واحد
- عناصر اصلی
- عناصر اصلی جدول تناوبی
- عناصر بلوک d
- عناصر جامد
- عناصر چند اتمی
- عناصر دو اتمی
- عناصر صنعتی
- عناصر گازی
- عناصر گروه ششم جدول تناوبی
- عناصر گروه های اصلی جدول تناوبی
- عناصر گروه های اصلی و عناصر واسطه پرکاربرد
- عناصر مایع
- عناصر و ویتامین ها در خوراکی ها
- عناصر واسطه
- عناصری که لایه s و p آن ها در حال پر شدن است
- عنصر
- عوامل زیان آور فیزیکی
- عوامل مؤثر در مقاومت الکتریکی
- عوامل موثر بر سرعت واکنش
- عیار سنجی نیترات نقره
- غذای سالم
- غزل شهسواری
- غزل فکری
- غزل کرانی
- غزل نوریان
- غلام حسین همایونی
- غلظت
- غلظت درصد
- غلظت درصد در شیمی
- غلظت سولفوریک اسید
- غلظت گرم بر لیتر
- غلظت محلول ها
- غلظت معمولی
- غلظت مولار
- غلظت نرمال
- غلظت نرمالیته
- غلظت ها
- فائزه حبیب اللهی
- فائزه دشتی مکان
- فائزه رستمی
- فائزه فرخی
- فائزه کرمی
- فائزه محمددوست
- فائزه مفتخری
- فاطمه آزموده
- فاطمه احمدی
- فاطمه ادراکی
- فاطمه اشتیاق
- فاطمه اعتمادی
- فاطمه افشاری
- فاطمه تقی زاده
- فاطمه جانقربان
- فاطمه جعفری
- فاطمه حاجی نسب
- فاطمه حداد پور
- فاطمه حیدری
- فاطمه حیدری حسن
- فاطمه دولت
- فاطمه زارعی
- فاطمه زهرا یزدانمهر
- فاطمه زوار موسوی
- فاطمه سادات پروره
- فاطمه سادات رحمانی
- فاطمه سادات موسوی
- فاطمه سلامت
- فاطمه سلطانی
- فاطمه شادکام
- فاطمه شرفی زاده
- فاطمه صدری
- فاطمه عبادی
- فاطمه عربلو
- فاطمه عظیم زاده
- فاطمه علی بالایی
- فاطمه غلامشاه زاده
- فاطمه قنبری
- فاطمه کاکایی
- فاطمه کوچکی
- فاطمه کیانی
- فاطمه مقدم
- فاطمه منصوری
- فاطمه نوشین ایرانپور
- فاطمه واحدتی نیا
- فاطمه یونسی
- فاکتورهای تبدیل غلظت
- فانتا کروم
- فایبر گلاس
- فایزه السادات موسویان
- فرآیند تولید آب ژاول
- فراصوت
- فرانسه
- فراوان ترین عنصر کیهان
- فرایند لحیم کاری
- فرزانه یزدان پناه
- فرزین رمضانی
- فرکانس چیست
- فرمانت
- فرمول تجربی
- فرمول رنگ کروم
- فرمول رنگ های راکتیو
- فرمول ساختمانی دی تیونو اسید
- فرمول ساده
- فرمول شیمیایی مواد رنگزای راکتیو
- فرمول شیمیایی مواد رنگزای مستفیم
- فرمول فانتا کروم
- فرمول فرکانس
- فرمول گرم بر لیتر
- فرمول گسترده مولکول حلقوی گوگرد
- فرمول محاسبه طلا
- فرمول مولکولی
- فرمول نویسی و نام ترکیبات
- فرمول های دود زا
- فرمول های رقیق کردن
- فرمول های سرعت متوسط
- فرمول های شیمیایی
- فرمول های نرمالیته
- فرمولاسیون کرم
- فرمیوم
- فرناز شمسی دخت
- فرنیا ایزدی
- فرواسکوربینات
- فروش پایان نامه
- فروشنده سود پرک و سود سوز آور
- فرولاکتات
- فریک آمونیم سولفات
- فریک سیترات
- فریک سیترات آمونیاکی
- فسژن چیست
- فسفات کلسیم
- فسفر
- فسفرسانس
- فسفریک اسید
- فشار
- فشار اتمسفری
- فشار بخاراشباع
- فشار جو
- فشار در مایعات و اثبات رابطه محاسبه فشار در ستون مایعات
- فشار کل
- فشار مایعات
- فشار مطلق
- فشار نسبی
- فشار و واحدهای آن
- فشفشه
- فعالیت فلزات در جدول تناوبی
- فعل و انفعالات افزایشی گوگرد دی اکسید
- فلئور
- فلئوراپاتیت
- فلئوریت
- فلز
- فلز روی
- فلز مایع
- فلز های غیر نقره ای
- فلز واسطه
- فلز یا نا فلز
- فلزات
- فلزات رنگی
- فلزات قلیایی
- فلزات قلیایی خاکی
- فلزات مایع
- فلزهای رنگی
- فلزی
- فلش کارت شیمی
- فلش کارت شیمی، نامگذاری
- فلوئورسانس
- فلوریت
- فناوری پیل سوختی پلیمری
- فنل فتالئین
- فنلاند
- فنیل ایزوسیانات
- فهیمه رحمانی
- فهیمه کریمی
- فهیمه کریمی کار شناس ارشد شیمی معدنی
- فهیمه کریمی کارشناس ارشد شیمی معدنی
- فواره آمونیاک
- فوتوسنتز
- فوتولومینسانس
- فورفورال
- فوشین
- فولرین
- فویل آلومینیم
- فیبر کربن
- فیپس
- فیتو شیمی تلگرام
- فیزیک گوگرد
- فیلم باروت سفید
- فیلم باروت سیاه
- قابلیت انحلال
- قابلیت انحلال گوگرد
- قابلیت انحلال گوگرد در حلالها
- قابلیت انحلال نمک ها
- قالیشویی ها از سودپرک
- قانون آووگادرو
- قانون رائول
- قرمز متیل
- قطبیت
- قلع
- قلع کلرید
- قلیا
- قهوه
- قهوه ای بیسمارک
- قواعد تعیین عدد اکسایش
- قوانین آرایش الکترون نقطه ای
- قوانین زیست محیطی
- قیچی ژنتیکی
- قیمت تولیدی هیدروژن
- قیمت سود پرک
- كاتاليزورهای سه راهه
- کات کبود
- کاتالیزگر نیکل
- کاتالیزور
- کاتالیزور Catalyst
- کاتالیزور در پیل های سوختی
- کاتالیزورهای ناهمگن
- کاتالیزورهای همگن
- کاتدولومینسانس
- کاتیون
- کاتیون ها و آنیون ها
- کاتیون ها و آنیون های متداول
- کادمیم
- کادمیم سولفید
- کاربرد آردوینو در شیمی
- کاربرد پتاسیم نیترات
- کاربرد چگالی در مسائل شیمی آلی
- کاربرد سدیم نیترید
- کاربرد سود پرک
- کاربرد شیمی در پرستاری
- کاربرد های الکترولیز
- کاربرد های گالیم
- کاربردهای آب اکسیژنه در خانه
- کاربردهای برلیوم
- کاربردهای بوراکس
- کاربردهای پتاسیم پرمنگنات
- کاربردهای روش کندوپاش
- کاربردهای گرافن
- کاربردهای گلسیرین
- کاربردهای لومینسانس
- کاربردهای نانوکپسول ها
- کاربردهای نرمالیته
- کارخانه قند
- کارخانه قند اصفهان
- کارخانه هیدروژن سبز
- کارگاه عملیات
- کارگاه های آموزشی قطب کشوری نانو
- کاریکاتور عناصر
- کاغذ pH
- کاغذ پی اچ
- کاغذ تورنسل
- کاغذ معرف گاز کلر
- کافئین
- کالج علوم
- کالیبراسیون رفراکتومتر
- کالیبره
- کالیفورنیوم
- کامپوزیت
- کامپوزیت چیست
- کامپوزین پلیمری
- کامیون هیدروژنی
- کانادا
- کانال تلکرام خانه شیمی ایران
- کانال خانه شیمی ایران
- کانی کلسیم فلوئورید
- کانی متبلور بور سیلیکات
- کانی های فلوئور
- کانی های فلوئور در یک نگاه
- کانی های معدنی
- کاهش
- کاهش پتاسیم پر منگنات
- کاهش کربن
- کاهش گازهای آلاینده خروجی
- کاوازاکی
- کاوش کنید یک
- کاویتاسیون
- کبالت
- کتاب تست های شیمی کالج های انگلستان
- کتاب شیمی برای عموم
- کتاب کنترل فرایند
- کراس اوور
- کربن
- کربن خالص صفر
- کربن دی سولفید
- کربن زدایی
- کربن سولفید
- کربن صفر
- کربنات کلسیم
- کربنات های فلزی وقتی گرم شوند اکسید فلز و کربن دی اکسید می دهند
- کربنزدایی
- کربنزدایی بخش گرمایش
- کرم سیستامین
- کرم های سفید کننده
- کرم های گیاهی
- کره جنوبی
- کروکویت
- کروم
- کروم(III) هیدرواکسید
- کروم(VI) اکسید
- کروموفور
- کرومیک اسید
- کرونا
- کروناویروس
- کریپتون
- کریستال ها
- کریستالیزاسیون
- کریستالیزاسیون گوگرد
- کریولیت
- کسرا کاشانی پور
- کشتن انگل های زیر جلدی باآب اکسیژنه
- کشتن موریانه
- کشتی تجدید پذیر
- کشتیرانی
- کل یون های تک اتمی و چند اتمی شیمی در یک جدول
- کلثوم جمالی
- کلر
- کلرات های فلزی وقتی حرارت داده شوند به کلرید فلز و اکسیژن تجزیه می شوند
- کلراسیون متان
- کلرس
- کلرس سانتریفوژ
- کلروفیل
- کلریداوریک
- کلریدفریک
- کلسیت
- کلسیم
- کلسیم در مواد غدایی
- کلسیم سولفات
- کلسیم سولفید
- کلسیم هیدرواکسید
- کلوفنیم
- کلید شناخت جهان
- کمال الدین قرنجیک
- کمپلکس فعال
- کمپلکسومتری
- کمک های اولیه
- کمومتریکس
- کمیت
- کمیت ها
- کمیکال
- کنترل فرایندهای شیمیایی
- کنترل کننده الکترونیک قدرت
- کنترل کننده، استفاده از پیل سوختی
- کنداکتومتر
- کنداکتومتر دست ساز
- کنسرو تخم مرغ
- کنسرو کردن تخم مرغ
- کنکور تجربی
- کنکور شیمی
- کنکور و المپیاد شیمی
- کوارتز
- کوارتز رز
- کوارتز سرخ
- کوارتز سرخ فام
- کوارتز مشعشع
- کوپرنسیوم
- کوثر حسین زاده
- کوثر ماندگاری
- کوثر محمدی
- کوجیک اسید
- کوجیک اسید( پاورپوینت)
- کوچکترین عدد اکسایش
- کودهای شیمیایی
- کوره بخار
- کوریوم
- کوژیک اسید
- کوسیان
- کوکامیدوپروپیل بتائین
- کووالانسی
- کیان دروید
- کیان درویدگ
- کیان کیانی
- کیان کیانی اندروید
- کیان کیانی دبیر شیمی
- کیان کیانی شیمی معدنی
- کیانا نره ای
- کیانا نسبی
- کیپ هیدروژن سولفید
- کیزلقور
- کیسه هوا
- کیسه هوای اتوموبیل
- کیمیا فشکی
- کیمیکال
- کیمیکال پلاس
- کیمیکال گوگرد
- کیهان کیانی
- کیوان صانعی
- گادولینیم
- گاران تل
- گارانتل
- گارانتل اسید کلریدریک
- گاز آب
- گاز انیدرید سولفورو
- گاز ایده آل
- گاز حاصل از سوختن باروت
- گاز خنده
- گاز سولفورو
- گاز سولفورو اکسید
- گاز طبیعی
- گاز کلر
- گاز کلر سمی
- گاز کلر می تواند ید را از محلول آزاد کند
- گاز نیتروژن
- گاز های ایده آل
- گاز های نجیب
- گازهای آتشفشانی
- گازهای گلخانه ای
- گازهای نجیب
- گازومتر
- گالن PbS
- گالیم
- گچ
- گرافیت
- گرد و غبار و مولکول ها در فضا
- گرم بر لیتر
- گرم شدن کره زمین
- گرما در واکنش های شیمیایی
- گرما شیمی یازدهم
- گرمای انحلال
- گرمای تشکیل
- گرمای تشکیل مولی
- گرمای واکنش
- گرمایش خانگی
- گرمایش زمین
- گرمل در واکنش های شیمی
- گروه
- گروه آزو
- گروه تولیدی شیمیایی کلران
- گروه تولیدی گوهر شیمی
- گروه شیمی تلگرام
- گروه شیمیدان های ایرانی در تلگرام
- گروه شیمیدانان ایرانی: محمد علی محمود آبادی تلگرام
- گروه های الکترون گیرنده
- گروه های شیمی تلگرام
- گروه های شیمی در تلگرام
- گروه های فعال کننده حلقه بنزن
- گروه های فعالیت زدا حلقه بنزن
- گل آفتاب گردان جاذبی برای مواد رادیواکتیو
- گل سفید
- گل گوگرد
- گل ممبران
- گند زدایی تخته گوشت
- گندزدایی
- گندزدایی اپن باآب اکسیژنه
- گندزدایی اسفنج ظرف شویی
- گندزدایی جراحت های کوچک با آب اکسیژنه
- گندزدایی کردن
- گندزدایی مسواک باآب اکسیژنه
- گوسین فاطمه فهیمی تلگرام
- گوگرد
- گوگرد بتا
- گوگرد پلاستیکی
- گوگرد تری اکسید
- گوگرد تک اتمی
- گوگرد چسب مانند
- گوگرد حلقوی
- گوگرد دارای سه ایزوتوپ
- گوگرد را رسوب دهید
- گوگرد رومبیک
- گوگرد زرد
- گوگرد زنجیری
- گوگرد سبز
- گوگرد سوزنی
- گوگرد شش اتمی
- گوگرد عنصری است عایق الکتریسیته
- گوگرد کش سان بسازید
- گوگرد منشوری
- گوگرد منو اتمی
- گوگرد منوکلنیک
- گوگرد هشت اتمی
- گوگرد هگزا فلئورید
- گول این دستگاه تست آب را نخورید
- گیاهان دارویی ،کورتیکواستروئیدهای موضعی
- لارنسیوم
- لانتان
- لاندن )
- لاووازیه
- لباس کار آزمایشگاه
- لباس های سفیدتر آب اکسیژنه
- لحیم چیست
- لحیم کاری
- لحیم کاری استیل
- لحیم کاری گالوانیزه
- لسیتین
- لعیا محمدی
- لکه پرمنگنات
- لوزی خطر
- لوله های پی وی سی فاضلابی و آبرسانی
- لیتارژ
- لیتموس
- لیتیم
- لیتیوم
- لیست آنیون ها و کاتیون ها
- لیست آنیون ها و کاتیون ها در شیمی
- لیلا ابوئی
- لیلا ابوئی دانشجوی کارشناس ارشد شیمی معدنی
- لیلا ابویی
- لیلا حیدری
- لیلا حیدری مهرداد
- لیلا کریمزاده
- لیلا مثقالی
- لیمونن
- لیمونن (اسانس پوست پرتقال)
- لینک دبیرخانه صنایع شیمیایی
- لینوکس شیمی
- لینوکس و نرم افزار های شیمی باز متن
- لینولئوم
- مائده امامدادی
- مائده جعفری
- مائده عباسی
- مائده قمرپور
- مائده کوهی
- مائده کوهی کارشناس ارشد شیمی معدنی
- مائده کوهی کارشناس شیمی کاربردی
- مائده مجدم
- مائده یوزباشی
- ماده رنگزا
- ماده رنگزای مستقیم
- ماده ضد بو
- ماده فعال سطحی
- ماده مرکب
- ماده موثر ضد بو
- مارتین
- مارکت کیان دروید
- ماکرومولکول
- مالزی
- مانومتر
- ماه بانو سادات
- ماهوت پاک کن
- مایده کوهی
- ماینتریوم
- مبانی شیمی اتمسفر و اختر شیمی
- مبدل کاتالیزوری
- مبدل های کاتالیستی سه راهه
- مبینا احمدی
- مبینا ترابی لنگری
- مبینا دشتی
- مبینا رختیانی
- مبینا رنجبر
- مبینا شریفی
- مبینا عبادی
- مبینا فتوت
- مبینا کمالی
- مبینا ملکی یامی
- مبینا هنگام پور
- متا
- متا نیترو تولوئن
- متان
- متانول
- متیل آنیلین
- متیل الکل
- متیل اورانژ به چه الیافی تمایل به جذب دارد
- متیل رد
- مثلث رنگرزی
- مثلث رنگرزی با مواد رنگزای مستقیم
- مثلث کشتیرانی
- مجتبی اسدی
- مجتبی اسدی پاورپوینت شیمی
- مجتبی اسدی شیمی
- مجهول فرآیند
- مجید سلامت
- مجید کلوئی
- مجید کلوئی پاورپوینت شیمی
- محاسبات استوکیومتری و غلظت ها
- محاسبات اسید و باز
- محاسبات پی پی ام
- محاسبات پی پی ام(ppm)
- محاسبات در صنایع شیمیایی
- محاسبات رنگرزی
- محاسبات رنگرزی در آزمایشگاه
- محاسبات شیمی
- محاسبات شیمیایی
- محاسبات غلظت درصد
- محاسبات محلول ها
- محاسبات مهندسی شیمی
- محاسبات مهندسی کارخانه قند
- محاسبات مولاریته
- محاسبات مولالیته
- محاسبات نرمالیته
- محاسبه pH
- محاسبه ph اسید
- محاسبه pka
- محاسبه اکی والان حجمی
- محاسبه پی اچ
- محاسبه پی اچ اسید
- محاسبه پی اچ باز
- محاسبه پی اچ تامپون
- محاسبه پی اچ حمام رنگرزی
- محاسبه چگالی
- محاسبه فشار
- محاسبه فشار /حجم / دمای گاز ایده آل
- محاسبه فشار مطلق
- محاسبه فشار مطلق/ نسبی/ اتمسفری
- محاسبه فشار نسبی
- محاسبه گاز ایده آل
- محاسبه گاز حاصل از سوختن یک گرم باروت سیاه
- محاسبه گر شیمی
- محاسبه مقدار رسوب در الکترولیز
- محاسبه مولاریته
- محاسبه نرمالیته
- محدثه حسن بیگی
- محدثه حسن بیگی کارشناس شیمی کاربردی
- محدثه رحیمی
- محدثه صادقی
- محدثه طاهری
- محدثه مجدم
- محدثه یوسف وند
- محدوده پی اچ
- محسن زمانی چریانی
- محسن هادیان
- محفظه احتراق
- محلول
- محلول ایمی
- محلول بافر
- محلول پرمنگنات پتاسیم
- محلول تامپون
- محلول تامپون یا بافر
- محلول سازی
- محلول سپید کننده ید را آزاد می کنید
- محلول شوایتزر
- محلول لوگول
- محلول ها
- محلول ها در شیمی
- محلول ها ی آتش گیر
- محلول ید
- محلولها ی آتش گیر
- محمد امین تارخ
- محمد امینی
- محمد جواد جهازآتشی
- محمد حسن حاجی پور
- محمد حسین حاجی پور
- محمد حسین سلطانی
- محمد رضا حیاوی
- محمد رضا فکرت اندیش
- محمد رضا قاسمی
- محمد روفیان
- محمد طاها نادری زاده
- محمد طاها نادری زاده
- محمد عسگری
- محمد عظیمیان زواره
- محمد علی جوادی
- محمد علی محمود آبادی
- محمد لطفی زاده
- محمد منصوری
- محمد نامداری
- محمد یوسفی دکتری شیمی معدنی
- محمدرضا فکرت اندیش
- محمدرضا قاسمی
- محمدرضا محمدیان
- محمدرضا محمدیان، سجاد سوبرانی، رضا نصیری، محمدرضا فکرت اندیش، علی صفدریان، علی شیرازی، شایان مهری، کیان کیانی
- محمود شهبازی
- مخزن ذخیره حرارت
- مخزن سوخت هیدروژن
- مخلوط پلی استر/پنبه یا ویسکوز
- مخلوط پلی استر/پنبه/ویسکوز
- مخلوط پنبه/ویسکوز
- مخلوط سدیم بیکربنات و سیتریک اسید
- مخلوط منواکسیدکربن و هیدروژن
- مداد ابرو
- مداین
- مدرج کردن آمپرسنجها
- مدرسه حاج مسیح الله کوپایی
- مدرسه حاج مسیح الله کوپایی، شهرضا
- مراحل تهیه قند
- مراحل خرید از کیان دروید
- مربای به
- مرتبه پیوند
- مرتضی حسینی
- مرتضی حسینی پاورپوینت شیمی
- مرتضی نیکدست
- مرجان اکبرپور
- مردار سنگ
- مرز بین پیوند یونی و کووالانسی
- مرضیه اسمائیلی
- مرضیه الله وکیلی
- مرضیه دشتی زاده
- مرکز نجوم ادیب
- مریم امامی
- مریم ایفانی
- مریم بصیری
- مریم تمیمی
- مریم حبیبی
- مریم شاه میرزایی
- مریم طاهر خانی
- مریم علی اصغری
- مریم علی اصغری کارشناسی ارشد شیمی تجزیه
- مریم فتاحی
- مریم فتحی
- مریم گردانشکن
- مریم محمد تاتاری
- مریم مربوط
- مریم نظری
- مزایای پیل های سوختی
- مزایای کندوپاش
- مزه ترش اسیدها
- مژگان شاه مندی
- مژگان ضرغام پور
- مس
- مس آنتی باکتریال
- مس اکسید
- مس(II) سولفات
- مس(II) سولفید
- مسائل مهندسی
- مسابقات قهرمانی آفرود هیدروژنی
- مسابقه هوش فنی ارتباط با شیمی نساجی
- مسعود صادقیان
- مسعود قنبری
- مسعود هراتیان
- مسمومیت با گاز کلر
- مسمومیت ناشی از ترکیبات گوگردی
- مسیح صادقی
- مشاوره آبکاری
- مشاوره چاپ
- مشاوره رنگرزی
- مشاوره شیمی
- مشاوره شیمی نساجی
- مشاوره صنایع شیمیایی
- مشخصات اتم
- مشروبات بدون الکل
- مشروبات بی الکل
- مصرف انرژی
- مصرف سوخت
- مطهره پاکدل
- مطهره سیفی
- معادله واکنش
- معادله واکنش بساز و موازنه کن
- معادله واکنش بساز و موازنه کن به روز شد
- معایب پیل های سوختی
- معایب کندوپاش
- معدن موگالاکونا
- معرف اسید و باز
- معرف شیمی
- معرف گاز کلر
- معرف متانول و اتانول
- معرف های شیمی
- معرف یونیورسال
- معرفی فرآیندهای لومینسانس و فوتولومینسانس
- معرفی کامپوزیت ها
- معرفی محور پیشنهاده پژوهش نوآورانه
- معرفی محور مدرس کوچک
- معرفی نرم افزارهای رایگان به جای ویزیو
- معصومه تقی زاده
- معصومه صالحی
- معمای تشکیل سیاره
- معین صامتی
- مغناطیس ها
- مفاهیم محلول ها
- مفهوم سرعت متوسط تولید یا مصرف مواد شرکت کننده
- مقادیر استوکیومتری یا نسبت استوکیومتری استوکیومتری واکنش
- مقادیردارو به روش HPLC
- مقاله مدارس هوشمند
- مقاله های خانم شهره فردادوند
- مقاله های شیمی
- مقاومت الکتریکی
- مقایسه تعین عیار ذوب قلیایی با دستگاهی و کوپلاسیون و تیتراسیون
- مقایسه ی خواص عناصر گروه (VIA) با یکدیگر:
- مقایسه ی خواص عناصر گروه ششم با یکدیگر
- مقدار میلی لیتر اسید/باز لازم برای تهیه محلول با نرمالیته مشخص
- مقدمه ای کلی در شیمی رنگ ها
- مقدمه مواد رنگرزی
- مقدمهای بر لومینسانس
- مکانیکال
- مکعب پی اچ
- مکعب مول
- مکعب مولار
- مکعب مولاریته
- ملاحضاتی در ساخت مواد رنگ زا
- ملاس
- ملاس چغندر قند
- ملوک نیک نشان
- ملیکا محمدپور
- منابع آب
- منابع آب و روش های تصفیه آن
- منابع آب و و روش های تصفیه آن
- منابع انرژی
- منبع آلاینده هوا
- منحنی فشار بخار
- مندلیوم
- منصوره حامدی
- منصوره حامدی کارشناس ارشد شیمی آلی
- منظومه شمسی
- منعقد کننده
- منگنز
- منگنز(II) کربنات
- منواکسید گوگرد
- منیر افشاری
- منیزیم
- مهدی اسحاقی استاد فیزیک
- مهدی اسحاقی استاد نجوم
- مهدی اسحاقی دکترای فیزیک
- مهدی اسحاقی دکترای کیهان شناسی
- مهدی اسحاقی ستاره شناسی
- مهدی اسحاقی فیزیک
- مهدی اسحاقی کیهان شناسی
- مهدی اسحاقی نجوم
- مهدی اسمائیلی دنارتی
- مهدی اسماعیلی
- مهدی اسماعیلی دنارتی
- مهدی اسماییلی دنارتی
- مهدی اسماییلی دنارتی مهندس شیمی در شرکت پالایش نفت جی بندر عباس
- مهدی بروجی
- مهدی حسن زاده
- مهدی خوش فطرت
- مهدی شفاعت
- مهدی عنایتی
- مهدی کاظمی
- مهدی کمالی
- مهدی مبرزی
- مهدی یعقوبی
- مهدیه احمدپور
- مهدیه تیموری
- مهدیه رحیمی
- مهدیه فرهمند
- مهدیه محمد خانی
- مهرشاد حیدری
- مهرناز مرویلی
- مهسا جعفری
- مهسا حاجی آقا
- مهسا داوری
- مهسا محمدی
- مهشید مهربخش
- مهنا سرور
- مهنا شاهرودی
- مهناز بخشنده
- مهندس زهرا سادات
- مهندس زهرا فراهانی
- مهندس زهرا(ماه بانو) سادات
- مهندس سید احمد طباطبایی
- مهندس صابر رشتاک
- مهندس کیوان صانعی
- مهندس لیلا قندی
- مهندس ماه بانو سادات
- مهندس محسن هادیان
- مهندس محمد رضا رجالی
- مهندس مهدی اسماعیلی
- مهندس مهدی اسماعیلی دنارتی
- مهندس مهدی شفاعت
- مهندس مهدی فقیهی
- مهندس مهران عباسی
- مهندس مونا علی اکبری
- مهندسی شیمی
- مهندسی شیمی نساجی
- مهندسی نساجی
- مهنوش منجزی
- مواد اکسید کننده
- مواد پاک کننده فلزات
- مواد خالص
- مواد خالص و نا خالص
- مواد رنگرزی
- مواد رنگزا
- مواد رنگزای آزو
- مواد رنگزای خمی
- مواد رنگزای خوراکی
- مواد رنگزای دایلون
- مواد رنگزای دایلون چند منظوره
- مواد رنگزای راکتیو
- مواد رنگزای سنتزی
- مواد رنگزای طبیعی
- مواد رنگزای گوگردی
- مواد رنگزای مستقیم
- مواد رنگزای نامحلو
- مواد رنگزای نساجی
- مواد رنگزای واکنشی
- مواد ضد عفونی
- مواد ضد عقونی
- مواد ظاهر کردن اثر انگشت
- مواد گند زدایی
- مواد لحیم کاری
- مواد مخلوط
- مواد موثر در پاک کردن انواع شیشه
- مواد مورد استفاده در لحیم کاری
- موارد استعمال آب اکسیژنه
- موازنه اکسایش کاهش
- موازنه اکسیژن و هیدروژن به ویژه در نیمه واکنشها
- موازنه واکنش باروت سیاه
- موازنه واکنش های شیمیایی
- موتور احتراق داخلی
- موتور الکتریکی
- موتور پیستونی
- موج
- موقعیت فلوئور در جدول تناوبی
- مول
- مولار
- مولاریته
- مولالیته
- مولتی استیج
- مولر
- مولکلول های چند اتمی
- مولکلول های هومواتمیک
- مولکول غول آسا
- مولکول غیر قطبی
- مولکول قطبی
- مولکول قطبی و غیر قطبی
- مولکول قطبی و ناقطبی
- مولکول گرم
- مولکول گوگرد
- مولکول های تک اتمی
- مولکول های هترواتمیک
- مولکولی) ساختار لوییس: آرایش الکترون نقطه ای
- مولیبیدن
- موم
- مونا علی اکبری
- مونواکسید گوگرد
- میکرو حفره
- میکروسکوپ کفلر
- میلاد گرجی
- میلی ولت
- مینا بهمنی
- مینا سلیمانی
- مینا شهابی
- میناشهابی
- مینی بوس هیدروژنی
- میهمانی فلزات قلیایی و هالوژن ها
- میوه کاج
- نئودیمیم
- نئون
- ناتینگهام meteorite
- نازنین آتشروز
- نازنین زهرا علیمردانی
- نازنین نظری
- ناسا
- نافلز
- نافلزات
- نام برلیوم
- نام عناصری که باید بشناسیم
- نام قدیمی ترکیبات
- نام گذاری ترکیبات یونی و کووالانسی استوکیومتری
- نام گروه های جدول تناوبی
- نام های قدیمی ترکیبات شیمیایی
- نامتقارن
- نامحلول
- نامگذاری
- نانو امولسیون
- نانو امولسیون ها
- نانو شیمی ابوالفضل زیارتی
- نانو کپسول
- نانو کپسول ها
- نانو کپسول ها Nanocapsules
- نانو لوله های کربنی
- نانوذرات فلزی
- نانوکپسول های پلیمری
- نانوکپسول های کربنی
- نانومتر
- نپتونیوم
- نتایج اندازه گیری دقت و صحت
- نجمه شکاری گیسی
- نجمه محمدی
- نجوم
- نحوه تشخیص نوع فلز
- نحوه کار با رفراکتومتر
- نحوه نمونه گیری و نمونه برداری
- ندا سبزیخانی
- نرجس خدابخشی
- نرجس عبدلی بحری
- نردبان آلفا
- نرگس امین پور
- نرگس صنما
- نرگس کاهکش
- نرگس یونسی
- نرم افزار ChemDraw
- نرم افزار باز متن
- نرم افزار شیمی
- نرم افزار شیمی برای موبایل
- نرم افزار کم دراو
- نرم افزار های بازمتن شیمی
- نرم افزار های شیمی
- نرم افزار های شیمی باز متن
- نرم افزار ویرایشگر شیمی آنلاین
- نرم افزار ویزیو
- نرم افزار ویزیو در شیمی
- نرم افزارهای اپن سورس شیمی
- نرم افزارهای شیمی
- نرم افزارهای مشابه ویزیو
- نرمال
- نرمالیته
- نرمالیته محلول اسید
- نشادر
- نشادر روی اکسید
- نشت یاب هیدروژن
- نغمه فرامرزی
- نقره
- نقره ایزانلو
- نقره به نقره
- نقره طبیعی
- نقره نیترات
- نقش اسید نیتریک در لحیم کاری
- نقش فلز سرب در لحیم کاری
- نقش فلز قلع در لحیم کاری
- نقش فلز قلع و سرب در لحیم کاری
- نقش مس سولفات در شیمی تجزیه
- نقش نشادر در لحیم کاری
- نقش نوشادر در لحیم کاری
- نقشه
- نقطه جوش عناصر جدول تناوبی
- نقطه حباب
- نقطه ذوب
- نقطه ذوب عناصر جدول تناوبی
- نقطه ذوب و جوش مواد
- نقطه شبنم
- نکات اکسایش کاهش
- نکات الکترولیز
- نکات بنزن
- نکات تستی شیمی کنکور
- نکات تعادل
- نکات تعادل ها
- نکات شیمی
- نکات کنکور شیمی
- نکات کنکوری
- نکات کنکوری شیمی
- نکات محلول ها
- نکات نعادل ها
- نکاتی در مورد تعیین عدد اکسایش
- نکته شیمی
- نکته کنکور شیمی
- نکته های کنکور شیمی
- نکته های کنکوری شیمی
- نگار آقا کابلی
- نگار آقاکابلی
- نگار آقاکابلی-سلماز حیدریان
- نگار غلامیان
- نگارسادات آقاکابلی
- نگهداری رفراکتومتر
- نگین احمدی
- نگین اکبری
- نگین پیلتن
- نگین حسینی
- نگین شرافتی
- نگین میر اعلایی
- نگین نظری
- نماد های تجهیزات فرایندی
- نمایش آذرخش در لوله آزمایش
- نمایشگاه ماشین
- نمک
- نمک + اسید
- نمک + باز
- نمک + نمک
- نمک اپسوم منیزیم سیلیکات
- نمک اسیدی از نمک نرمال
- نمک خوراکی
- نمک روی روی سولفید
- نمک سفره
- نمک طعام
- نمک فلزی
- نمک قالبی
- نمک گوبر
- نمک میوه
- نمک نرمال از نمک اسیدی
- نمک های معدنی
- نمک های ید
- نمودار خطی
- نمونه ای از ساخت کرم
- نمونه تمرین های شیمی
- نمونه مسائل شیمی شیمی پیش دانشگاهی
- نهیه نیتروژن دی اکسید
- نوبلیوم
- نور
- نور های جادویی احمد قبادی
- نور، کلید شناخت جهان
- نوشابه مشکی
- نوشادر
- نوشتن با هیدروژن سولفید
- نوشتن معادلات شیمیایی و موازنه آن ها
- نوشین تبریزی
- نوید قاسمی
- نویسندگان: نگار آقاکابلی-سلماز حیدریان
- نویسنده: مهندس زهرا سادات
- نویسنده: مهندس زهرا(ماه بانو) سادات
- نویسنده: مهندس ماه بانو سادات
- نیترات به نیتریت
- نیترات پتاسیم
- نیترات نقره
- نیتراسیون بنزن
- نیتروزن اکسید
- نیتروژن
- نیتریک اسید
- نیروی لاندن
- نیروی واندروالس
- نیشکر
- نیکتا دهقانی
- نیکل
- نیلوفر حیدری
- نیلوفر روستا
- نیلوفر عباسی
- نیلوفر محمد پور
- نیلوفر یاوری
- نیلوفر یاوری شیمی کاربردی
- نیما ابراهیمی
- نیما روشن ضمیر
- نیما فرخی
- نیما مویدی
- نیما یدملت
- نیمه هادی های بی شکل
- نیوبیم
- هاسیوم
- هالوژناسیون متان
- هانیه خانیان
- هانیه کرمی
- هِد پمپ
- هدایت
- هدایت الکتریکی
- هدایت سنج دست ساز
- هستی احمدی
- هستی قاسم پور
- هستی هنگام پور
- هشت حقیقت جالب درباره ی طلا
- هفت روش تهیه نمک
- هگزافلوئورید گوگرد
- هلیانتین
- هلیوم
- همجوشی اکسیژن
- همجوشی کربن
- همجوشی نئون
- همجوشی هلیوم
- همجوشی هیدروژن
- همکاری با سایت کیمیکال
- همه چیز درباره مولکول
- هموژنایزر
- هموگلوبین
- همی اکسیدگوگرد
- هند
- هنرستان اسماعیلی
- هنرستان بنت الهدی صد
- هنرستان بنت الهدی صدر
- هنرستان پروین اعتصامی اصفهان
- هنرستان پروین اعتصامی سورشجان استان چهارمحال بختیاری
- هنرستان حاج مسیح الله کوپایی
- هنرستان خلیج فارس بندر عباس
- هنرستان خلیج فارس هرمزگان
- هنرستان رازی
- هنرستان رازی اصفهان
- هنرستان رازی کرمان
- هنرستان رشد خراسان شمالی
- هنرستان فنی رازی
- هنرستان فنی رازی اصفهان
- هنرستان فواد الفنون
- هنرستان فوادالفنون
- هنرستان کوپایی شهرضا
- هنرستان نمونه دولتی خلیج فارس بندر عباس
- هواپیماهای هیدروژنی
- هواپیمای دونفره
- هواپیمای مارتین
- هواپیمای مسافربری
- هوازی
- هوافضایی و پهپاد
- هوانوردی
- هوای آلوده شهرها
- هورمون فلیکل
- هورمون های درون تخم مرغ
- هوش فنی شیمی نساجی
- هولمیم
- هومواتمیک
- هیبریداسیون
- هیبریدی Shahab Nooshmand
- هیپوکلریت سدیم
- هیدراتاسیون
- هیدرواکسید
- هیدرواکسید روی
- هیدرواکسید کلسیم
- هیدروژت یدید بسازید
- هیدروژل
- هیدروژن
- هیدروژن آبی
- هیدروژن اسیدی در آلکین ها
- هیدروژن پر اکسید
- هیدروژن پلی سولفیدها یا سولفانها (Sulfanes)
- هیدروژن سبز
- هیدروژن سولفوره
- هیدروژن سولفید
- هیدروژن سولفید پرمنگنات
- هیدروژن سولفید شناسایی
- هیدروژن سولفید طلا
- هیدروژن کلرید
- هیدروژن مایع
- هیدروژنی
- هیدروفلئوریک اسید
- هیدروفلوئوریک اسید
- هیدروکربن های اکسیژندار در فراسوی کیهان
- هیدروکربنهای آروماتیک چند حلقهای
- هیدروکسی ازوبنزن
- هیدروکینون
- هیدرولیز
- هیدرولیز آبکافت
- هیدرولیز آمونیم یدید
- هیدرولیز اتیل برمید
- هیدرولیز پتاسیم هیدروژن سولفید
- هیدرولیز منیزیم اتیل برمید
- هیدرولیز نمک ها
- هیدرومتر
- و نکات مربوط به حل مسئله
- واپاشی آلفا
- واپاشی بتا
- واحد اندازهگیری فشار
- واحدها
- وازلین
- واژه نامه اختر شیمی
- واسر گلاس
- واسرگلاس
- واکنس سیلیسیم با سولفوریک اسید
- واکنش
- واکنش آلکین ها با فلزات قلیایی
- واکنش آلکین ها با مس(I)کلرید آمونیاکی
- واکنش آلکین ها با نقره نیترات آمونیاکی
- واکنش آلومینیم و سود سوز آور
- واکنش آهن و کات کبود
- واکنش آهن و مس(II) سولفات
- واکنش اثر هیدروکلریک اسید را بر منگنز دی اکسید
- واکنش اسید ها با شناساگرها
- واکنش اسید و باز
- واکنش اسیدها با فلزات
- واکنش اکسید فلز با اسید
- واکنش اکسید هالوژن ها با آب
- واکنش اکسید های نافلز با آب
- واکنش اکسیداسیون و احیا
- واکنش اگزوترمیک
- واکنش ای پر منگنات پتاسیم
- واکنش با مس(I)کلرید آمونیاکی
- واکنش با نقره نیترات آمونیاکی
- واکنش باروت سیاه
- واکنش بین اسید و باز
- واکنش پرمنگنات با گوگرد دی اکسید
- واکنش پرمنگنات و گلسیرین
- واکنش تجزیه
- واکنش ترکیب
- واکنش تیوسولفات با هیدروکلریک اسید
- واکنش جابه جایی دوگانه
- واکنش جابه جایی ساده
- واکنش جانشینی دوگانه
- واکنش جانشینی ساده
- واکنش جیوه با سولفوریک اسید
- واکنش دهنده محدود ساز و اضافی
- واکنش دهنده محدود ساز و اضافی حل مسائل به روش استوکیومتری و از روش تناسب(کنکوری) به دست آوردن فرمول تجربی و مولکولی اغلب پرسش های تستی در این برنامه از تست های کنکور سراسری
- واکنش دهنده محدود کننده
- واکنش دو نمک با یکدیگر
- واکنش رنگ های راکتیو با سلولز
- واکنش رنگهای راکتیو
- واکنش روی با آمونیم نیترات با آب
- واکنش روی با سولفوریک اسید
- واکنش سدیم سولفیت با هیدروکلریک اسید
- واکنش سود با گاز کلر
- واکنش سولفوریک اسید و پتاسیم پر منگنات
- واکنش عناصر اصلی
- واکنش فسفر با سولفوریک اسید
- واکنش فلز با اسید
- واکنش فلز با نافلز
- واکنش فلزات با اسید ها
- واکنش فلزات قلیایی با آب
- واکنش فلزات قلیایی خاکی با آب
- واکنش قند با سولفوریک اسید
- واکنش کربن با سولفوریک اسید
- واکنش کربن با نیتریک اسید
- واکنش کرماده
- واکنش کلر با آمونیاک
- واکنش کلر با سولفوریک اسید
- واکنش کلر با نیتریک اسید
- واکنش گاز کلر با آهن
- واکنش گاز کلر با سود سوزآور سرد و رقیق
- واکنش گاز کلر با سود سوزآور گرم و غلیظ
- واکنش گاز کلر با فلزات
- واکنش گرمازا
- واکنش گرماگیر
- واکنش گوگرد اکسید با آب
- واکنش گوگرد با سولفوریک اسید
- واکنش مس با سولفوریک اسید
- واکنش مس با نیتریک اسید رقیق
- واکنش مس با نیتریک اسید غلیظ
- واکنش منگنز دی اکسید و هیدروکلریک اسید
- واکنش میخ و کات کبود
- واکنش نافلزات با اسیدها
- واکنش نقره با سولفوریک اسید
- واکنش نمک با اسید
- واکنش نمک با سولفوریک اسید
- واکنش نمک با یک باز
- واکنش نمک خوراکی با سولفوریک اسید
- واکنش نیتریک اسید و آهن
- واکنش نیتریک اسید و مس
- واکنش ها
- واکنش های آروماتیک
- واکنش های افزایشی گوگرد دی اکسید
- واکنش های اکسایش کاهش
- واکنش های ایجاد شده در لحیم کاری
- واکنش های ایرباگ
- واکنش های ایربگ
- واکنش های سولفوریک اسید
- واکنش های شکافت هسته ای
- واکنش های شیمی کنکور
- واکنش های شیمیایی
- واکنش های شیمیایی کنکور
- واکنش های شیمیایی گوگرد
- واکنش های شیمیایی هنگام پخت و پز
- واکنش های فتوشیمیایی
- واکنش های فلزات واسطه
- واکنش های کیسه ی هوا
- واکنش های گوگرد
- واکنش های لحیم کاری
- واکنش های مس
- واکنش های نیتروژن
- واکنش های هسته ای در ستارگان و ابرنو اختر ها
- واکنش های هسته ای در ستاره ها
- واکنش هسته ای
- واکنش هیدرات های کربن با سولفوریک اسید
- واکنش هیدروژن برمید با سولفوریک اسید
- واکنش هیدروژن یدید با سولفوریک اسید
- واکنش یتروژن دی اکسید با آب
- واکنش یون روی با محلول آمونیاک
- واکنشهای افزایشی گوگرد تری اکسید
- واکنشهای هستهای
- وانادیت
- وانادیم
- وایتکس
- وب سایت شیمی
- وب سایت شیمی کیمیکال
- وب سایت های شیمی
- وب سایت های شیمی (اپلیکیشن)
- وب سایت های شیمی ایرانی
- وب سایت های شیمی خارجی
- وب سایت های مفید شیمی
- وبسایت دبیرخانه راهبری صنایع شیمیایی
- وبسایت های مفید شیمی
- وزن حجمی
- وسایل گازسوز
- وسایل نقلیه هیدروژنی
- وظیفه فلز سرب در لحیم کاری
- وظیفه قلع در لحیم کاری
- ولتاژ بالا
- ونتوری متر
- ویدیو آشنایی با گلسیرین
- ویدیو نمایش اربیتال ها
- ویدیو های آموزش اسید
- ویدیو های آموزش واکنش های شیمیایی
- ویدیو های شیمی
- ویرایش گر شیمی
- ویرایش گر شیمی آنلاین
- ویژگی بازها
- ویژگی بلورها
- ویژگی قلیایی ها
- ویژگی ها و روش آزمون رنگ آستری بر پایه رزین آلکید واکسید آهن
- ویژگی های بنزوئیک اسید
- ویژگی های پر منگنات
- ویژگی های شیمیایی گوگرد
- ویژگی های گالیم
- ویلیانمیت
- یا کوارتز مشعشع آتشین
- یا کوارتز مشعشع رنگین کمانی
- یاسر آقا ابراهیمی سیچانی
- یاسره افرا
- یاسره لفرل
- یاسمن غلامی
- یاسمن محبوبی
- یاسمن محبی
- ید
- یکاها
- یکتا اثنی عشران
- یکتا حیدری
- یکتا کریمی
- یگانه اینانلو
- یگانه دهقان نژاد
- یگانه رضایی
- یلدا سپهری
- یلدا شربتی
- یوروپیوم
- یوسف اعتصامی
- یولت
- یون فلز
- یون گرم
- یون ها (آنیون و کاتیون)
- یون های فلزی
- یونس رحیمی
- یونی
- یونیزاسیون سولفوریک اسید
- یووارووایت
- همه
- افسانه حبیبی
- کیان کیانی
- مریم علی اصغری
- ابوالفضل امیراعظمی
- امیر حسین غریبی
- الهام کامران پور
- منصوره حامدی
- محدثه حسن بیگی
- ایمان انصاری
- مائده کوهی
- زهرا(ماهبانو) سادات
- مهدی اسماعیلی دنارتی
- حسن مدرک
- نیلوفر یاوری
- رضا زمانی
- صابر رشتاک
- سمیرا داتلی بیگی
- روح الله ساول زاده
- شهاب نوشمند
- سلماز حیدریان
- محمد طاها نادری زاده
- زهرا فراهانی
آبان ۷, ۱۳۹۸
منتشر شده بوسیله کیان کیانی در آبان ۷, ۱۳۹۸
اپلیکیشن اندرویدی رایگان “معادله واکنش بساز و موازنه کن” به روز شد. این اپلیکیشن در بخش درسنامه به طور کوتاه انواع واکنش های تجزیه، ترکیب، جانشینی […]
دوست داشتی؟4
آبان ۱, ۱۳۹۸
منتشر شده بوسیله کیان کیانی در آبان ۱, ۱۳۹۸
اپلیکیشن اندرویدی اکسایش کاهش در تاریخ ۲۸ مهر ۹۸ به روز شد. این اپلیکیشن که شش سال پیش توسعه داده شد، ابتدا در مارکت بازار منتشر […]
دوست داشتی؟2
مهر ۱۴, ۱۳۹۸
منتشر شده بوسیله کیان کیانی در مهر ۱۴, ۱۳۹۸
پیل الکتروشیمیایی (آهن-مس) تبدیل انرژی شیمیایی به انرژی الکتریکی به صورت عملی مواد لازم: نیتریک اسید, تیغه آهنی, تیغه مسی, نمک خوراکی وسایل لازم: دو عدد […]
دوست داشتی؟3
اسفند ۲۲, ۱۳۹۷
منتشر شده بوسیله کیان کیانی در اسفند ۲۲, ۱۳۹۷
دسته ها
چرا محدوده یا رنج pH از ۰ تا ۱۴ است ؟ لطفا کامل و مختصر و با اثبات عددی توضیح بدین همان طور که می دانیم […]
دوست داشتی؟6
دی ۲, ۱۳۹۷
منتشر شده بوسیله کیان کیانی در دی ۲, ۱۳۹۷
دسته ها
در ادامه ی ساخت مکعب مول و مکعب مولار این بار آموزش ساخت مکعب پی اچ را آموزش می دهیم. ۱- یک مکعب مقوایی بسازید که […]
دوست داشتی؟3
آذر ۱۸, ۱۳۹۷
منتشر شده بوسیله کیان کیانی در آذر ۱۸, ۱۳۹۷
دسته ها
به روز رسانی از اتم تا استوکیومتری تغییرات: برطرف شدن یک باگ برای توضیح بیشتر، مشاهده ی تصاویر و دانلود اپلیکیشن بر روی آیکون اپلیکیشن از […]
دوست داشتی؟4
آبان ۲۵, ۱۳۹۷
منتشر شده بوسیله کیان کیانی در آبان ۲۵, ۱۳۹۷
اپلیکیشن آموزش محلول ها در شیمی به روز شد تغییرات: ۱- به روز رسانی ظاهر گرافیکی با تم سرخ (اپلیکیشن سرخ) ۲- جایگزینی امکان تماس مستقیم […]
دوست داشتی؟2
شهریور ۲۱, ۱۳۹۷
منتشر شده بوسیله کیان کیانی در شهریور ۲۱, ۱۳۹۷
دسته ها
مفاهیم کلیدی: *پی پی ام(ppm) یعنی قسمت در میلیون که سنجشی برای اندازه گیری غلظت محلول ها است. *برای محلول های بسیار رقیق غلظت های وزنی/وزنی […]
دوست داشتی؟43
شهریور ۹, ۱۳۹۷
منتشر شده بوسیله کیان کیانی در شهریور ۹, ۱۳۹۷
دسته ها
پس از آموزش ساخت مکعب مول اکنون نوبت ساخت مکعب مولار است. در زیر آموزش ساخت یک مکعب شامل مفاهیم مولاریته را به شما آموزش می […]
دوست داشتی؟2