آتش سوزی بوسیله آب
بهمن ۲۵, ۱۳۹۶
چهار عمل اصلی شیمی
اسفند ۱, ۱۳۹۶خواص شیمیایی منوکسید گوگرد
خواص شیمیایی SO بقرار زیر است:
الف- ناپایداری در اثر حرارت: منوکسید گوگرد در اثر حرارت خیلی سریع تجزیه می شود بطوریکه در حرارت ۱۸۰ در زمانی برابر یک دقیقه تمامی آن تجزیه می گردد و فرمول تجزیه آن معلوم نیست و بعضی ها فرمول تجزیه آن را بصورت زیر می دانند:
2S2O2 → 2SO2+ S2
با اینکه منوکسید گوگرد ناپایدار است، ولی تحت فشاری کمتر از ۴۰ میلی متر جیوه در ظروفی کوارتزی کاملاً خشک آنرا می توان چند روزی نگهداری نمود.
ب- اثر اکسیژن: در حرارتی برابر ۱۵۰ درجه سانتی گراد تحت فشارهای کم (مثلاً تحت فشاری برابر ۲ میلی متر جیوه) منوکسید گوگرد در اثر اکسیژن اکسید شده و مخلوطی از گوگرد، گاز دی اکسید گوگرد و تری اکسید گوگرد بوجود می آید.
ج- اثر هالوژنها: از اثر هالوژنها بر منوکسید گوگرد تولید تیونیل های مربوطه می گردد مانند فرمول زیر که از اثر گاز کلر بر منوکسیدگوگرد کلرورتیونیل تولید می شود:
SO + Cl2 → SOCl2
د- اثر آب: هر گاه آب بر منوکسید گوگرد اثر داده شود خیلی سریع تجزیه شده (یعنی منوکسید گوگرد خیلی سریع تجزیه می شود) و سولفید ئیدروژن و اسید سولفورو تولید می نماید که فرمول آن بقرار زیر است:
3SO + 3H2O → 2H2SO3 + H2S
سزکوئی اکسید گوگردS2O3 : هر گاه پودر گوگرد خالص را به تری اکسید گوگرد مایع اضافه کنند، پس از چند لحظه در سطح آن (در سطح SO3 مایع) مایع آبی رنگی دیده می شود که آنرا از رسوب جدا کرده و پس از اینکه در خلا در حرارت ۳۹ تا ۴۰ خشک کردند بلورهای آبی رنگی بدست می آید که همان سزکوئی اکسید گوگرد می باشد. و این اکسید یعنی بلورها دارای فرمول عمومی
می باشند که در حرارت معمولی بیش از چند دقیقه پایدار نمی ماند. از تجزیه سزکوئی اکسید گوگرد مخلوطی از SO2 و SO3 و گوگرد بوجود میآید.
هر گاه بر سزکوئی اکسید گوگرد آب اثر داده شود محلول زردرنگ بدبوئی تولید می شود که مقداری هم گوگرد همراه دارد.
دی اکسید گوگرد SO2
گاز انیدرید سولفورو (دی اکسید گوگرد) گازی است که در گازهای آتشفشانی و در هوای شهرهای صنعتی وجود دارد. گازی است بیرنگ و با بوی تند و زننده که در صورت تنفس باعث سرفه های شدید می گردد.
گاز انیدرید سولفورو در ۷۵- منجمد و در ۱۰- می جوشد و در نتیجه می توان آنرا در فشار یک جو در دمای ۱۰- به مایع تبدیل نمود (همچنین در فشار ۳ جو در دمای ۱۵ نیز به مایع تبدیل می شود). گاز انیدرید سولفورو بمقدار زیاد در آب حل می شود ولی قابلیت انحلال آن در اثر افزایش درجه حرارت کاهش مییابد بطوریکه در دمای صفر درجه سانتی گراد ۶۹ لیتر و در دمای ۴۰ مقدار ۱۷ لیتر از آن در یک لیتر آب می تواند حل شود.
گاز انیدرید سولفورو ۲/۲۶ برابر از هوا سنگین تر است یعنی:
d= 64/29
مایع وقتی که سریع بخار می شود گرمای فوق العاده زیادی از محیط خود دریافت می نماید و در نتیجه میتواند حرارت محیط خودش را تا 60- پایین آورد و این خاصیت آن باعث شده است که در صنعت مثلاً در یخ سازی از آن برای ایجاد سرما استفاده نمایند.
گاز انیدرید سولفورو علاوه بر آب در بسیاری از مواد آلی از قبیل بنزن، تولوئن، اسید استیک، الکل و انیدرید استیک حل می شود بطوریکه قابلیت انحلال آن در این ترکیبات آلی بیشتر از آب می باشد.
انیدرید سولفورو وقتی که مایع است می تواند بسیاری از نمکهای معدنی و آلی را در خودش حل نماید یعنی حلال نمکهای معدنی و آلی است، بطوریکه هالوژنورها را می تواند در خودش حل نماید و هر چه وزن مولکولی نمکهای مذکور (هالوژنورها) بیشتر باشد قابلیت انحلال آنها در انیدرید سولفوروی مایع بیشتر است و بعبارت دیگر هر چه هالوژن شرکت کننده در هالوژنوری سنگین تر باشد افزایش قابلیت انحلال آن در SO2 مایع بیشتر می گردد. هیدروکربورهای حلقوی و غیر اشباع نیز بخوبی در SO2 مایع حل می گردند (برخلاف هیدروکربورهای زنجیری).
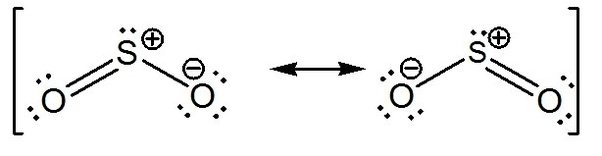
ساختمان الکترونی را به دو صورت مزومری زیر می توان نمایش داد:
نویسنده: علی نیکخو
ویرایش: کیان کیانی
دریگر مطالب مرتبط با گوگرد
برای سهولت در بازبینی وب سایت شیمی کیمیکال و ده ها وب سایت شیمی ایرانی و خارجی دیگر و شبکه های اجتماعی مرتبط و همچنین سهولت در به اشتراک گذاری مطالب آن ها اپلیکیشن رایگان کیمیکال پلاس را نصب کنید.