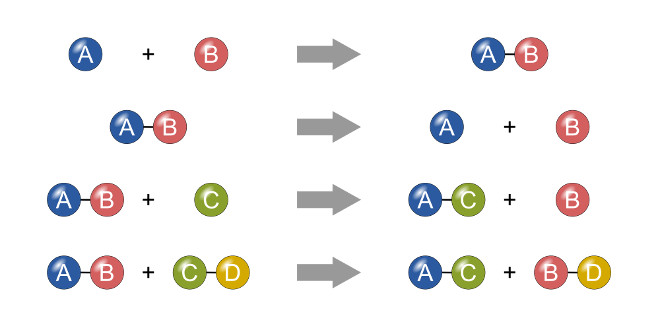
انواع واکنش های شیمیایی
شهریور ۷, ۱۳۹۵
نانو کپسول ها Nanocapsules
شهریور ۲۰, ۱۳۹۵نام دیگر این ترکیب شیمیایی هیدروژن اکسید است. در حالت خالص ماده ای بی رنگ، بی بو، شفاف، و بی مزه (بدون طعم) است. در فشار 760 میلی متر جیوه در دمای 100 درجه سانتی گراد(نقطه جوش) میجوشد و در دمای صفر درجه سانتی گراد منجمد(نفطه ذوب) میشود.
ساختار: مولکول آب دارای دو پیوند کوالانسی میباشد . اتم اکسیژن با دو اتم هیدوژن مثلث متساوی الاضلاع تشکیل میدهد.
زاویه HOH برآبر با 105 درجه میباشد.
فاصله هسته های O-H برآبر با 0.1013nm است.
فاصله هسته های H-H برآبر با 0.163nm است.
بسیاری از خواص آب، همچون خاصیت تجمع، رفتار حرارتی غیر عادی و همچنین تشکیل کمپلکسهای آبدار ناشی از گشتاور دوقطبی آب میباشد. گشتاور دو قطبی آب برآبر با 1/84*10-18 میباشد.توزیع متفاوت بارهای جفت الکترون های مشترک باعث ایجاد گشتاور قطبی در این مولکول میگردد.
ثابت دی الکتریک: توانایی یک حلال در جدا کردن بارهای مثبت و منفی از یکدیگر را ثابت دی الکتریک گویند.آب به دلیل ثابت دی الکتریک بالا حلال بسیار خوبی برای بسیاری از مواد است. و جز بهترین و پرمصرفترین حلال ها است. اسیدها و قلیاها و همچنین نمک ها در آب به صورت یون در میایند. همچنین آب در حالت مایع به مقدار قابل توجهی پلیمر میشود.
چنانچه در فرایند انحلال نمک ها، انرژی آبپوشی بالاتر از انرژی لازم برای تخریب شبکه بلوری باشد در این صورت محلول گرم و در غیر اینصورت محلول سرد میشود.
تفکیک بخار آب گرماگیر و تشکیل ان گرماده میباشد. به ازمایشی در این زمینه توجه کنید:
با عبور بخار آب از داخل یک لوله داغ، مقدار کمی اکیسژن و هیدوژن در آن تولید میشود ولی با خنک کردن آن فقط آب باقی میماند.بنابراین در دماهای بالاتر مقداری مولکول آب تفکیک شده و در دماهای پایینتر مولکول های آب (هیدوژن و اکسیژن) با یکدیگر ترکیب میگردند. برای تفکیک آب، انرژی مصرف شده و با ترکیب دوباره اکسیژن و هیدوژن بدست میآید بنابراین تفکیک بخار آب گرماگیر و تشکیل آن گرمازا است.
الکترولیز و رسانایی آب: آب خالص رسانای برق نیست اما با افزودن مقداری کم سولفوریک اسید، رسانایی ای بالا میرد، به گونه ای که با عبور جریان مستقیم از داخل آب گازهای هیدروژن و اکسیژن به نسبت حجمی 2 به 1 به ترتیب در قطب های منفی و مثبت اغاز میشود این روش تجزیه آب را الکترولیز میگویند.
آبکافت(هیدرولیز) آب: واکنش آب با ترکیبات گوناگون، آبکافت یا هیدرولیز نامیده میشود.
دانسیته آب: آب در دمای 4 درجه سانتیگراد دارای بیشترین دانسیته میباشد.به همین دلیل در هوای یخبندان آب 4 درجه سانتیگراد در پایین ترین قسمت قرار میگیرد.
آب تبلور ctrystall water
آبی که در مقادیر استوکیومتری به بلورها متصل باشد آب تبلور نام دارد. این ترکیب ها از نظم کامل برخوردار بوده و پیوندآنها از نوع کوئوردینانسی است(ترکیبهای کمپلکسی).
بر حسب تعداد کوئوردینانسیون یونها، تعدا مولکولهای آب شبکه بلوری میتواند 1، 2، 3، 4، 5، 6، 8، 12 و یا حتی 31 باشد.
بلورها با افزایش دما و کاهش فشار آب تبلور خود را از دست میدهند.
آب مقطر distilled water
آبی که مواد خارجی و به ویژه نمکهای آن توسط دستگاه تقطیر یا مبادله گر یونی زدوده شده است.
آب نرم soft water
آبی که دارای هیچگونه سختی موقت(سختی کربنات) و سختی دائم ( سختی غیر کربنات) نمیباشد. سختی موقت آب را بی کربنات های منیزیم و کلسیم موجود در آن تشکیل میدهند، در صورتیکه سختی دائم مشتمل بر وجود نمکهای منیزیم ، کلسیم و آنیونهایی مانند سولفات ها، کلریدها، سیلیکات ها و نیترات ها میباشد.
آب چشمه ها و رودخانه ها قریب 0.2 درصد مواد جامد، به صورت منیزیم و کلسیم را دارند که باعث سختی آب میشود.
آب طبیعی: آبهای طبیعی هرگز از لحاظ شیمیایی خالص نبوده و پیوسته حاوی مقادیرمواد معدنی و الی به صورت محلول یا تعلیق همراه خود دارند. آب باران و برف به نسبت خالص ترین آبها را تشکیل میدهند، زیرا نوعی فرایند تقطیر طبیعی را پشت سر گذاشته اند. آب مزبور حاوی هر گونه نمک بوده اما حاوی گرد و غبار است. در آب طبیعی علاوه بر اکیسژن 16مقدار ناچیزی اکسیژن 17 و اکسیژن 18 وجود دارد.
آب معدنی: آب های زیر زمینی که دارای مواد محلول معدنی و گاز باشند و یا خواص فیزیکی ویژه از خود نشان دهند، آب معدنی نامیده می شوند.
آب شیرین: آبی را که کمتر از یک گرم بر لیتر پسماند تبخیر داشته باشد، آب شیرین میگویند.
آب سنگین: علاوه بر مولکول هیدوژن و اکسیژن مولکولهای دیگری در آب موجودند.
از لحاظ شیمی فیزیکی سهم آب سنگین مهم است که حاوی ایزوتوپ هیدوژن به نام دوتریم است. مقدار آب سنگین در آب طبیعی بسیار کم و به نسبت تقریبی 1:5500 میباشد، که پس از غنی سازی میتواند به صورت آب خالص تفکیک گردد به بیانی دیگر شامل نسبت بیشتری از ایزوتوپ دوتریم هیدوژن در مقایسه با مقادیری است که به طور طبیعی در اب وجود دارد. و نام دیگر ان دوتریم اکسید است
آب نیمه سنگین: آب نیمه سنگین با فرمول شیمیاییHDO نیز در آب شناسایی و اثبات شده است.
آب سخت: ابی که شامل نمکهای ویژه ای است، مانند نمکهای از کلسیم و منیزیم در دیگ بخار که با صابون تشکیل رسوب میدهد.
منابع
فرهنگ تشریحی شیمی اس پی پارکر، ترجمه تقی رجبی و همکاران، تابستان 1389
فرهنگ توصیفی شیمی، پرویز بالازاده، 1386
http://wallpapercave.com/h2o-wallpaper
مریم علی اصغری کارشناسی ارشد شیمی تجزیه





1 Comment
خیلی عالی