خواص شیمیایی گوگرد
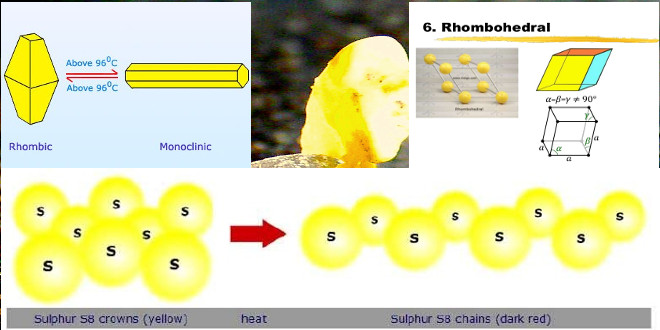
خواص فیزیکی گوگرد
بهمن ۱۸, ۱۳۹۶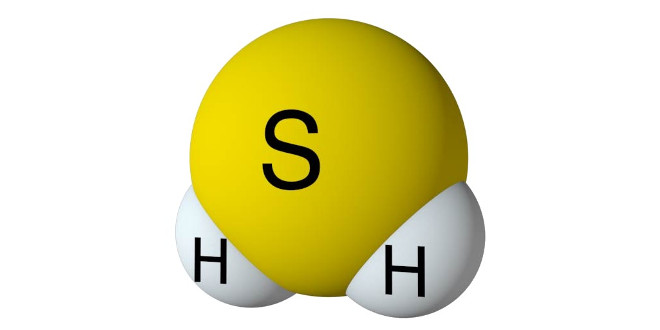
هیدروژن سولفید
بهمن ۲۰, ۱۳۹۶- اثر فلوئور بر گوگرد
- اثر گوگرد بر اکسیدهای قلیایی و قلیایی خاکی
- اثر گوگرد بر اکسیژن
- اثر گوگرد بر الماس
- اثر گوگرد بر بر
- اثر گوگرد بر برم
- اثر گوگرد بر روی
- اثر گوگرد بر سیلیسیم
- اثر گوگرد بر فلئور
- اثر گوگرد بر فلزات
- اثر گوگرد بر فلزها
- اثر گوگرد بر کادمیم
- اثر گوگرد بر کربن
- اثر گوگرد بر کلر
- اثر گوگرد بر مس
- اثر گوگرد بر نیتروژن
- اثر گوگرد بر هالوژن ها
- اثر گوگرد بر هیدروژن
- اثر گوگرد بر ید
- ازت
- انیدرید سولفورو
- انیدرید سولفوریک
- بخار گوگرد
- بوریک اسید
- پنتاسولفید
- تترا سولفید تترا ازت
- تترا سولفید تترا نیتروژن
- تترا سولفید دی نیتروژن
- تخلیه الکتریکی
- ترکیب دوتایی
- ترکیب گوگرد با فلزات
- تهیه گوگرد هگزا فلئورید
- خواص شیمیایی گوگرد
- درباره گوگرد
- درجات اکسایش گوگرد
- درجات اکسیداسیون گوگرد
- دی گوگرد دی کلرید
- روی سولفید
- سولفات کلسیم
- سولفور
- سولفور کربن
- سولفید کربن
- سولفید مس
- سولفید نیتروژن
- سیلیسیم آموروف
- سیلیسیم دی سولفید
- شیمی گوگرد
- شیمی هیدروژن سولفید
- صنعت گوگرد
- علی نیکخو
- عناصر صنعتی
- کادمیم سولفید
- کربن دی سولفید
- کربن سولفید
- کلسیم سولفات
- کلسیم سولفید
- گل گوگرد
- گوگرد هگزا فلئورید
- مس(II) سولفید
- هگزافلوئورید گوگرد
- هیدروژن سولفوره
- هیدروژن سولفید
- واکنش اکسیداسیون و احیا
- واکنش اگزوترمیک
- واکنش های گوگرد
- ویژگی های شیمیایی گوگرد
همانطوریکه می دانیم گوگرد می تواند درجات اکسایش (۲-)، ۴+ و ۶+ پیدا کند و برای کسب آن درجات اکسیداسیون در واکنش هایی شرکت می کند که در زیر تعدادی از آنها را می آوریم:
اثر بر ئیدروژن: هر گاه ئیدروژن را از روی گوگرد در حالت جوش عبور دهند بر هم اثر کرده و ئیدروژن سولفید (H2S) تولید می کنند طبق فرمول زیر:
H2 + S → H2S
اگر ئیدروژن اتمی باشد به آسانی با گوگرد بحالت جوش ترکیب می شود.
اثر بر اکسیژن: گوگرد در ۲۸۰ درجه سانتی گراد در اکسیژن با ایجاد شعله آبی رنگ ویژه ای می سوزد . در این فعل و انفعال تولید گاز انیدرید سولفورو می گردد و اگر گوگرد را بصورت ذرات بسیار ریزی درآورند حرارت اشتعال آن ۹۰ درجه پایین می آید یعنی ۱۹۰ درجه سانتی گراد می گردد. در اثر همین میل ترکیبی شدید با اکسیژن است که گوگرد می تواند اکسیژن اجسام اکسیژن داری مانند نیترات پتاسیم و کلرات پتاسیم را بگیرد، بطوریکه مخلوط آنها در اثر ضربه با حرارت بترتیب طبق فرمول های زیر منفجر می گردد:
2KClO3 + 3S → 3SO3+ 2KCl
2KNO3 + 4S → K2S + 3SO3+ N2
اثر بر نیتروژن– گوگرد می تواند با نیتروژن فعال که از تخلیه الکتریکی حاصل شده باشد ترکیب شده و سولفید نیتروژن تولید نماید که بفرمول S4N4 یا S4N2 می باشد (که بترتیب آنها را تتراسولفیدتترا ازت و تترا سولفید دی نیتروژن می گویند).
چون تشکیل S4N4 گرماگیر است، می تواند با یک انفجار به عناصر تشکیل دهنده خودش تجزیه شود، طبق فرمول زیر:
S4N4 → 4S+2N2 +128 KCal
اثر بر کربن:گوگرد در درجه حرارت های بالا با کربن ترکیب شده و تولید سولفور کربن به فرمول CS2 می نماید. بخار گوگرد در ۱۰۰۰ بر الماس اثر کرده و تولید CS2 می نماید طبق فرمول زیر:
C + 2S + Q → CS2
چون واکنش تشکیل CS2 شدیداً گرماگیر است بدینجهت وقتی که به کربن و گوگرد تجزیه می شود گرمای قابل ملاحظه ای ایجاد می نماید.
اثر بر هالوژنها: گوگرد با تمام هالوژنها باستثناء ید ترکیب شده و تولید ترکیب دوتایی می نماید.
گوگرد بشدت با فلوئور ترکیب شده و هگزافلوئورید گوگرد تولید می نماید طبق فرمول زیر:
3F2 + S → SF6+ 262KCal
گوگرد با کلر هم ترکیب شده و تولید دی کلرید دی گوگرد می کند که فرمول واکنش بصورت زیر است:
Cl2 + 2S → S2F2+ 14/4KCal
درست است که اثر کلر بر گوگرد کمی خفیف تر از اثر فلوئور بر گوگرد است ولی با این وضع اثر گاز کلر بر گل گوگرد حتی در سرما هم مشاهده می شود. در حرارت معمولی گوگرد با برم ترکیب و مایع روغنی دی برومید دی گوگرد تولید می کند طبق فرمول زیر:
Br2 + 2S → S2Br2+ 14/4KCal
اثر بر سیلیسیم: گوگرد بر سیلیسیم آموروف اثر کرده و دی سولفید سیلیسیم تولید می شود طبق فرمول زیر:
Si + 2S → SiS2
دی سولفید سیلیسیم براحتی در حرارت معمولی توسط آب ئیدرولیز شده و SiO2 تولید می کند طبق فرمول زیر:
SiS2 + 2H2O → SiO2+ 2H2S
ساختمان بلورین SiS2 از زنجیرهای طویلی درست شده است که در آن هر اتم گوگرد به دو اتم سیلیسیم متصل شده است که بصورت زیر نمایش داده می شود:
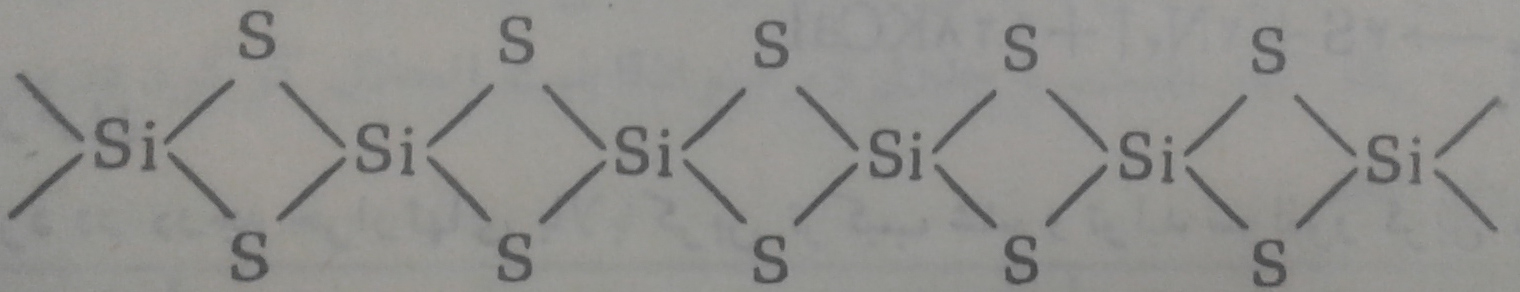
در زنجیر فوق هر کدام از اتمهای سیلیسیم بوسیله چهار اتم گوگرد که در رئوس یک چهاروجهی قرار گرفتهاند احاطه شده است.
اثر بر بر (B): گوگرد در درجه حرارت معمولی بر بر اثر ندارد ولی اثر آن از ۶۱۰ درجه سانتی گراد شروع شده و در ۱۲۰۰ درجه سانتی گراد جسمی بفرمول B2S3 بوجود می آید. از ئیدرولیز B2S3 تولید اسید بوریک و ئیدروژن سولفوره می گردد طبق فرمول زیر:
B2S3 + 6H2O → 2H3BO3 + 3H2S
اثر بر فلزات
گوگرد در حرارت معمولی تقریباً جسمی بی اثر محسوب می گردد ولی در اثر حرارت با اغلب فلزات به غیر از طلا و طلای سفید ترکیب و سولفید تولید می کند. هر گاه فلزات نانجیب مانند آهن و روی و غیره را با گوگرد مخلوط کرده و حرارت دهند ترکیب می شوند و تولید سولفید می کنند. واکنش ابتدا با ملایمت شروع شده و سپش شدت می یابد و مقدار زیادی هم حرارت ایجاد میکند، یعنی واکنش اگزوترمیک است. واکنش ترکیب گوگرد با فلزات یک واکنش اکسیداسیون و احیاست، یعنی گوگرد احیا و فلزات اکسید می گردند مانند مثالهای زیر:
Zn+S → ZnS+Q
Fe+S → FeS+Q
مس با گل گوگرد زیاد در حرارتی کمتر از ۴۰۰ درجه سانتی گراد ترکیب و CuS تولید می کند که جسمی سیاهرنگ میباشد طبق فرمول زیر:
Cu+S → CuS
گوگرد در حرارتی بالاتر از ۴۴۴/۶ (یعنی بخار گوگرد) با مس ترکیب و تولید می کند طبق فرمول زیر:
2Cu+S → Cu2S
کادمیم در اثر حرارت با گوگرد ترکیب شده و سولفید کادمیم CdS تولید می نماید و همچنین گوگرد با جیوه ترکیب و تولید سولفید مرکوریک بفرمول HgS (سیاهرنگ) می نماید.
فلزات قلیایی با گوگرد در اثر حرارت و فلزات قلیایی خاکی با بخار گوگرد (در حرارت بالاتر از ۴۰۰ درجه سانتی گراد) ترکیب شده و سولفید به وجود می آورند.
اثر بر اکسیدهای قلیایی و قلیایی خاکی: گوگرد با اکسیدهای قلیایی در گرما ترکیب و مخلوطی از سولفید، پنتاسولفید و سولفات تولید می نماید که نتیجه یک عده واکنشهای شیمیایی بقرار زیر می باشد:
3S + 2Na2O → 2Na2S+ SO2
S2O + Na2O → 2Na2SO3
4Na2SO3 → 3Na2SO4 + Na2S
S + Na2SO3 → Na2S2O3
4Na2S2O3 → 3Na2SO4 + Na2S5
گوگرد با اکسیدهای فلزات قلیایی خاکی هم در حرارت بالا ترکیب و سولفید و سولفات بوجود می آورد مانند مثال زیر:
4CaO + 4S → CaSO4+ 3CaS
بطوریکه فرمول نشان می دهد از اثر گوگرد بر اکسید کلیسم در حرارت بالا تولید سولفات کلسیم و سولفیدکلسیم می گردد.
نویسنده: علی نیکخو
دریگر مطالب مرتبط با گوگرد
برای سهولت در بازبینی وب سایت شیمی کیمیکال و ده ها وب سایت شیمی ایرانی و خارجی دیگر و شبکه های اجتماعی مرتبط و همچنین سهولت در به اشتراک گذاری مطالب آن ها اپلیکیشن رایگان کیمیکال پلاس را نصب کنید.





