هیدروژن سولفید

خواص شیمیایی گوگرد
بهمن ۱۹, ۱۳۹۶
تهیه هیدروژن سولفید
بهمن ۲۱, ۱۳۹۶- اثر احیاکنندگی هیدروژن سولفید
- اثر هیدروژن سولفید بر فلزات
- اثر هیدروژن سولفید بر نمک ها
- بوی بد شبیه بوی تخم مرغ گندیده
- چگالی هیدروژن سولفید
- خواص شیمیایی هیدروژن سولفید
- درباره گوگرد
- سوختن هیدروژن سولفید در اکسیژن
- سولفید ئیدروژن
- شیمی گوگرد
- شیمی هیدروژن سولفید
- صنعت گوگرد
- علی نیکخو
- کیان کیانی
- هیدروژن سولفید
- هیدروژن سولفید پرمنگنات
- هیدروژن سولفید شناسایی
- هیدروژن سولفید طلا
هیدروژن سولفید H2S گازی است سمی با بوی بد شبیه بوی تخم مرغ گندیده که چگالی آن نسبت به هوا ۱/۱۹۰ بوده و در هر لیتر آب مقدار ۴ لیتر H2S می تواند حل شود و در فشار ۱۰ اتمسفر و در صفر درجه سانتی گراد به مایع تبدیل می شود. دانسیته سولفید ئیدروژن مایع در شرایط معمولی تقریباً برابر ۰/۷۸۹ گرم بر سانتی متر مکعب است که با کاهش درجه حرارت مقدار آن افزایش می یابد. و در ۶۰/۷- درجه سانتی گراد به مایع تبدیل شده و در ۸۶- درجه سانتی گراد منجمد می گردد. ساختمان گاز سولفید ئیدروژن مانند ساختمان آب دو قطبی است و زاویه 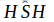 آن برابر ۹۲ درجه می باشد، وقتیکه بحالت جامد در می آید مقدار زاویه مذکور افزایش یافته و به ۱۰۹ درجه می رسد.
آن برابر ۹۲ درجه می باشد، وقتیکه بحالت جامد در می آید مقدار زاویه مذکور افزایش یافته و به ۱۰۹ درجه می رسد.
ساختمان مولکولی H2S بصورت زیر می باشد.
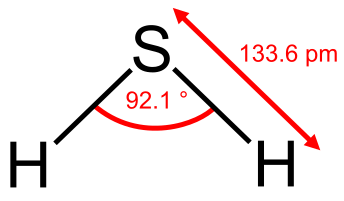
سولفید ئیدروژن در ابتدای قرن هیجدهم شناخته شده و در سال ۱۷۹۸ ترکیبش توسط برتوله (Berthollet) مشخص شده است. گازی است که در طبیعت اغلب همراه سایر گازها از شکافهای زمین (مخصوصاً در مناطق آتشفشانی) خارج می شود و گاهی نیز بصورت محلول در آبهای گرم و یا در آب بعضی از دریاها (مانند دریای سیاه) دیده میشود.
خواص شیمیایی– هیدروژن سولفید دارای پایداری ناچیزی است، بقسمی که می توان آنرا مخلوطی از هیدروژن نوزاد و گوگرد تلقی نمود و بدین جهت است که عناصریکه میل ترکیبی زیادی با ئیدروژن یا گوگرد دارند بسهولت می توانند با ترکیب شوند، در حرارت ۳۰۰ درجه سانتی گراد تجزیه آن به H2 و S شروع شده و در ۸۰۰ درجه در حدود ۶ درصد آن به گوگرد و ئیدروژن تبدیل می گردد که بصورت زیر می توان آنرا نمایش داد:
H2S → H2 + S + 2.5KCal
خواص شیمیایی دیگر بقرار زیر است:
اثر احیاکنندگی: گاز H2S در اثر اسید نیتریک غلیظ طبق فرمول زیر اکسیده شده و گوگرد آزاد میکند:
2HNO3 + H2S → S↓ + 2NO2↑ + 2H2O
اکسیدکننده های دیگر مانند آب کلر، آب اکسیژنه و کلرورهای رنگبر مانند کلرور دوشو می توانند طبق فرمول زیر را اکسید کرده و رسوب گوگردی آزاد نمایند:
H2S + Cl2→ S↓ + 2HCl
H2S + H2O2→ S↓ + 2H2O
H2S + 2FeCl3→ S↓ + 2HCl + 2FeCl2
گاز H2S در اثر اسید نیتریک دودکننده مشتعل شده و گاز SO2 می دهد.
اسید نیتریک رقیق سولفید ئیدروژن را اکسید کرده و خودش به اکسید نیتریک کاهش می یابد طبق فرمول زیر:
2HNO3 + 3H2S → 3S↓ + 2NO↑ + 4H2O
گاز H2S پرمنگنات پتاسیم را در محیط اسیدی بی رنگ کرده و در نتیجه گوگرد و Mn(II) تولید می گردد طبق فرمول زیر:
2KMnO4 + 5H2S +3H2SO4 → 5S↓ + K2SO4 + MnSO4 + 8H2O
بطوریکه دیده می شود در واکنش فوق هر Mn(II) به Mn(VII) تبدیل شده است یعنی ۵ درجه احیا شده است و هر S دو منفی به S صفر تبدیل شده و ۲ درجه اکسید شده است، پس پرمنگنات پتاسیم خاصیت اکسیدکنندگی و هیدروژن سولفید خاصیت احیاکنندگی از خود نشان داده است. بیکرومات پتاسیم هم مانند پرمنگنات پتاسیم عمل می کند.
یادآوری می شود که اگر در موقع اثر گاز H2S بر محلول پرمنگنات پتاسیم محیط را اسیدی نکنند فرمول واکنش بقرار زیر خواهد بود:
2KMnO4 + 8H2S → 5S↓ + K2S + 2MnS + 8H2O
سوختن در اکسیژن
گاز سولفید ئیدروژن در اکسیژن هوا با شعله آبی رنگی می سوزد و تولید گوگرد و SO2 می نماید، یعنی اگر مقدار اکسیژن کم باشد تولید گوگرد می شود طبق فرمول زیر:
سوختن ناقص
2H2S + O2 → 2S↓ + 2H2O
و اگر مقدار اکسیژن زیاد باشد تولید می شود که با فرمول زیر نشان داده می شود:
سوختن کامل
2H2S + 3O2 → 2SO2 + 2H2O
و گاز SO2 حاصل می تواند توسط گاز H2S احیا شده و طبق فرمول زیر گوگرد آزاد شود:
2H2S + SO2 → 3S + 2H2O
مخلوطی از H2S و O2 در حرارت ۲۲۰ تا ۲۲۳ (تحت فشار یک جو) مشتعل می شود در صورت افزایش فشار واکنش میان آنها با انفجار همراه می گردد. مخلوطی از ۱/۵ حجم اکسیژن (۷/۵ حجم هوا) و یک حجم سولفید ئیدروژن در اثر شعله منفجر می گردد (انفجار مستراحها نتیجه همین واکنش است).
اثر H2S بر فلزات: سولفید ئیدروژن با اینکه اسید ضعیفی است بر اغلب فلزات (باستثناء طلا و طلای سفید) اثر کرده و ئیدروژن و سولفید فلز مربوطه را بوجود می آورد (تشکیل سولفید نامحلول عمل را متوقف می کند)، اثر آن بر مس در سرما به تأنی است ولی با افزایش درجه حرارت اثر آن شدیدتر می گردد بطوریکه از حرارت ۵۵ به بالا واکنش اثر آن بر مس دو طرفه (برگشتی) شده و از ۶۰۰ درجه سانتی گراد به بالا سولفید مس (I) بوجود می آید طبق فرمول زیر:
2H2S + 2Cu → CuS + 2H2
در درجه حرارت معمولی و دور از هوا سولفید ئیدروژن خشک بر فلز نقره اثر ندارد ولی با وجود مقداری اکسیژن نقره را (یعنی سولفید ئیدروژن نقره را) فوری سیاه می کند. سولفید ئیدروژن خالص و خشک در ۱۹۰ درجه سانتی گراد با نقره ترکیب و سولفید نقره و ئیدروژن تولید می نماید طبق فرمول زیر:
2H2S + 2Ag → Ag2S + 2H2
در صورت وجود رطوبت و هوا در ۲۱۰ درجه سانتی گراد (حتی در حرارت معمولی) گاز H2S به آب و گوگرد تبدیل میگردد طبق فرمول زیر:
2H2S + O2 → 2H2O + 2S
و سپس گوگرد حاصل به سولفید تبدیل می گردد.
(در اثر واکنش قبلی است که در اطراف چشمههای آب معدنی گوگرددار رسوب گوگردی دیده می شود.)
اثر H2S بر نمکها: از اثر بر محلول بعضی از نمکها رسوب سولفید بوجود می آید و با استفاده از این فعل و انفعالات است که در آزمایشگاهها برای تشخیص فلز نمکهای محلول بعضی از فلزات استفاده می کنند مانند واکنش زیر که سولفید مس (II) تولید می شود:
H2S +CuSO4 → H2SO4 + CuS
طرز شناسایی گاز H2S : در آزمایشگاهها برای شناسایی H2S کاغذ آغشته به نیترات یا استات سرب را جلو آن گاز می گیرند کاغذ سیاه می شود، طبق فرمول زیر:
H2S +Pb(NO3)2 → 2HNO3 + PbS
نویسنده: علی نیکخو
ویرایش: کیان کیانی
سرچشمه عکس ها: ویکیپدیا
دریگر مطالب مرتبط با گوگرد
برای سهولت در بازبینی وب سایت شیمی کیمیکال و ده ها وب سایت شیمی ایرانی و خارجی دیگر و شبکه های اجتماعی مرتبط و همچنین سهولت در به اشتراک گذاری مطالب آن ها اپلیکیشن رایگان کیمیکال پلاس را نصب کنید.