با هم پیل بسازیم
اسید و باز-غلظت ها
اردیبهشت ۱۱, ۱۴۰۰
نقطه ذوب و جوش مواد
خرداد ۳, ۱۴۰۰در شیمی عمومی آموختیم فلزات دوست دارند الکترون از دست بدهند و نا فلزات دوست دارند الکترون بگیرند.
اما تمایل همه ی فلزات برای از دست دادن الکترون یکسان نیست.
مثلآ فلزات نجیب مانند طلا دوست ندارند الکترون از دست بدهند به همین دلیل شما می توانید طلا را در طبیعت به صورت خالص پیدا کنید.
اما فلزات قلیایی به سرعت الکترون از دست می دهند و به همین دلیل زیر نفت نگه داری می شوند و اگر در مجاورت هوا قرار بگیرند به سرعت کدر می شوند و با اکسیژن هوا واکنش می دهند.
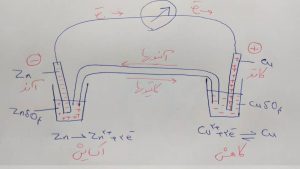
یا اگر تیغه روی را در محلول مس سولفات قرار دهیم روی در محلول مس سولفات حل می شود و فلز مس رسوب می کند.
یعنی واکنش زیر روی می دهد:

اما اگر تیغه مس را درون محلول روی سولفات قرار دهیم هیچ واکنشی روی نمی دهد
یعنی واکنش زیر به طور خود به خود روی نمی دهد:

این دو آزمایش نشان می دهند در مقایسه با فلز روی و مس ، فلز روی تمایل بیشتری به دادن الکترون دارد.
با توجه به تجربه ی بالا بیایید با هم گام به گام یک پیل بسازیم
پیل الکتروشیمیایی دستگاهی است که انرژی شیمیایی را به انرژی الکتریکی تبدیل می کند.
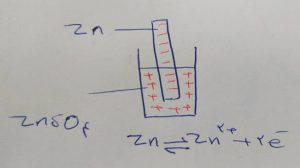
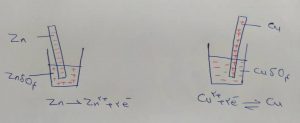
اگر یک تیغه روی را در محلول نمک آن ( مانند روی سولفات) قرار دهیم از آنجایی که فلز روی دوست دارد الکترون از دست بدهد مقداری در محلول حل می شود در نتیجه الکترون ها در تیغه می ماند و یون روی در محلول حل می شود پس از مدتی تیغه از بار منفی اشباع می شود و محلول از بار مثبت بنابر این عمل انحلال روی متوقف می شود واکنش به تعادل می رسد.
اکنون اگر در یک لیوان دیگر یک تیغه مس را در محلول نمک آن (مانند مس سولفات) قرار دهیم از آنجایی که مس دوست دارد الکترون بگیرد یون های مس درون محلول از تیغه الکترون می گیرد و مس فلزی تشکیل می دهد پس از مدنی چون تیغه از بار منفی خالی می شود و محلول از بار منفی اشباع می شود( به دلیل کاهش بار مثبت در اثر تبدیل یون مس به فلز مس) بنابر این عمل رسوب فلز مس بر روی تیغه متوقف می شود واکنش به تعادل می رسد.
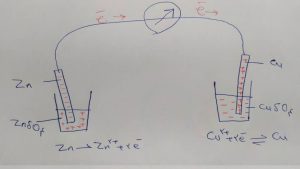
اکنون اگر یک سیم مسی به دو تیغه وصل کنیم و بین آن یک ولتمتر قرار دهیم مشاهده می کنیم که ولتمتر یک لحظه جریان را نشان می دهد (الکترون ها از تیغه روی که انباشته از الکترون است به تیغه مس که خالی از الکترون شده حرکت می کنند) اما سریع عقربه ولتمتر بر می گردد.
این به خاطر این است که الکترون ها که به طرف تیغه مس می روند با محلولی روبرو می شوند که بار منفی دارد و بار منفی همدیگر را دفع می کنند.
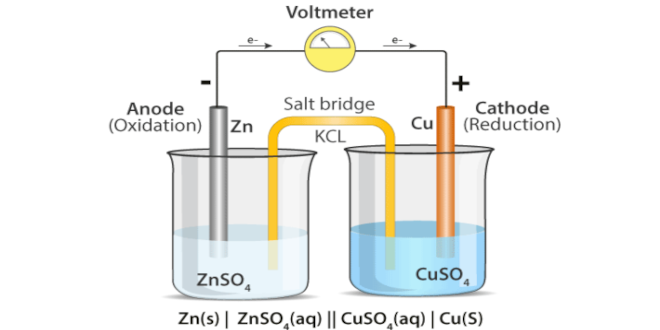
اگر دو لیوان را بوسیله یک پل نمکی به هم مرتبط کنیم مشاهده می کنیم که جریان به طور مداوم برقرار می شود.
پل نمکی محلول نمکی است که درون یک لوله U شکل ریخته شده و با هیچ یک از الکترولیت ها واکنش نمی دهد و کاتیون ها و آنیون ها را عبور می دهد.
نیم پیل روی که در آن عمل اکسایش انجام می شود آند نام دارد و قطب منفی است.
نیم پیل مس که در آن عمل کاهش انجام می شود کاتد نام دارد و قطب مثبت است.
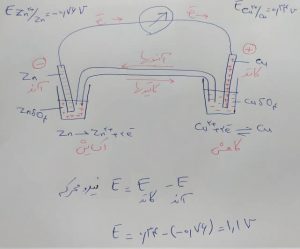
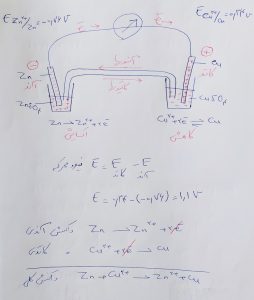
برای پیدا کردن کاتد و آند می توانیم از پتانسیل کاهش ها استفاده کنیم
پتانسیل کاهش کوچکتر آند است.
پتانسیل کاهش بزرگتر کاتد است.
همچنین از رابطه بالا می توانیم نیروی محرکه(ولتاژ) پیل را حساب کنیم.
واکنش های اکسایش-کاهش و واکنش کلی به قرار زیر است.