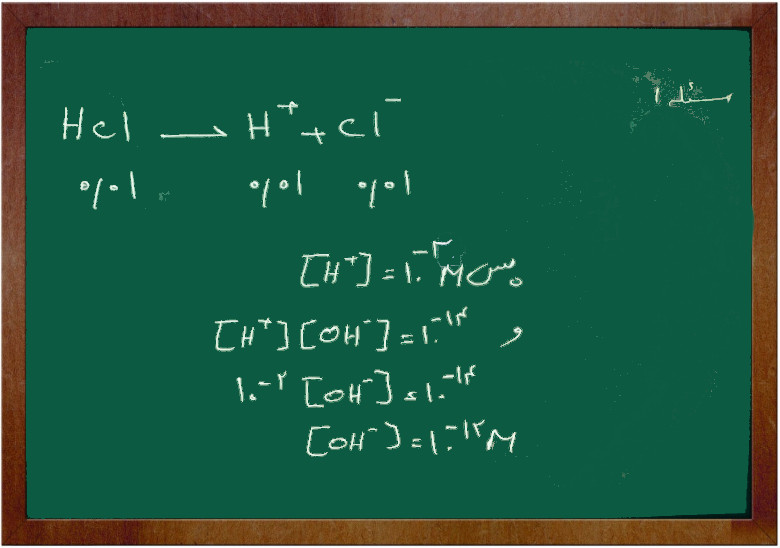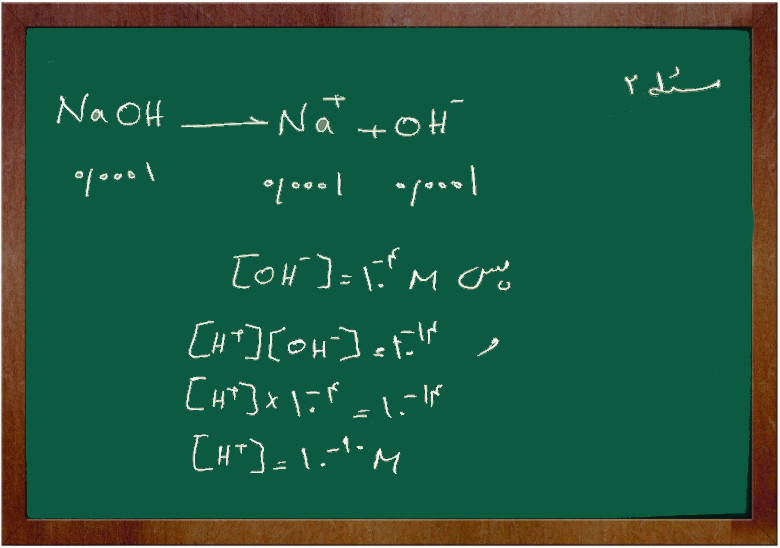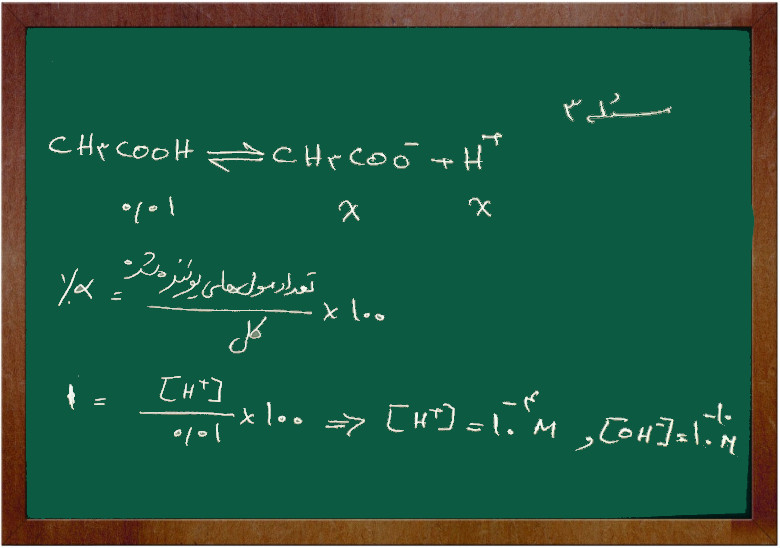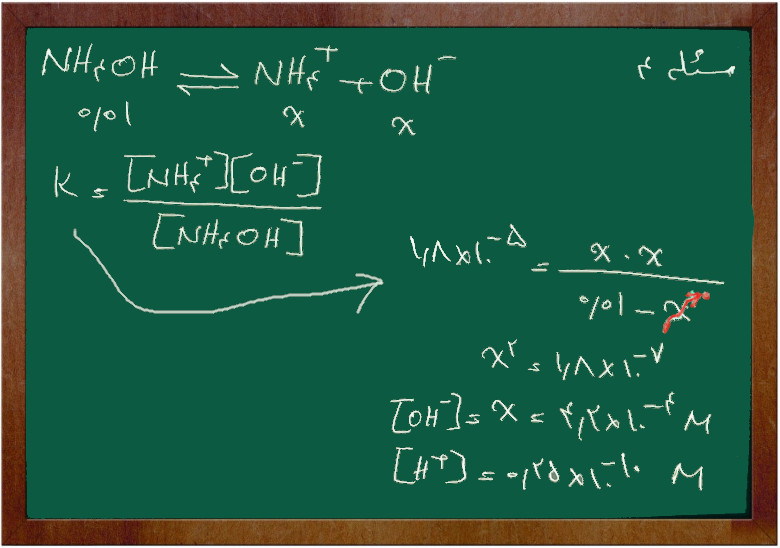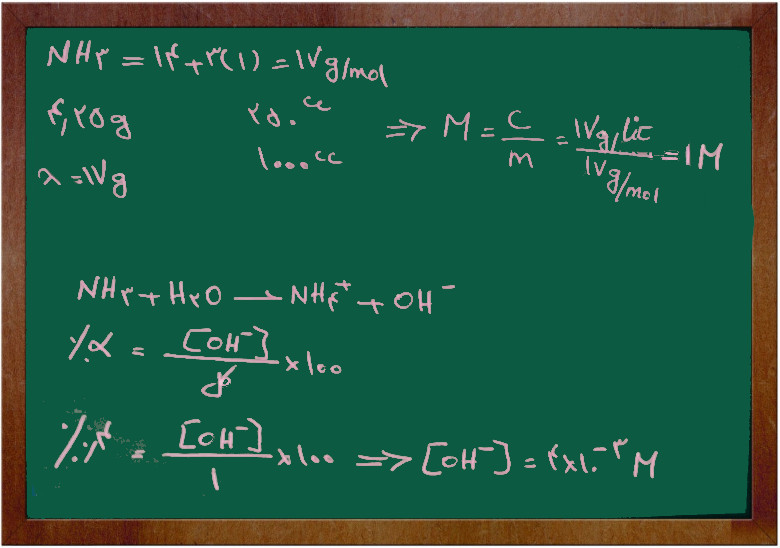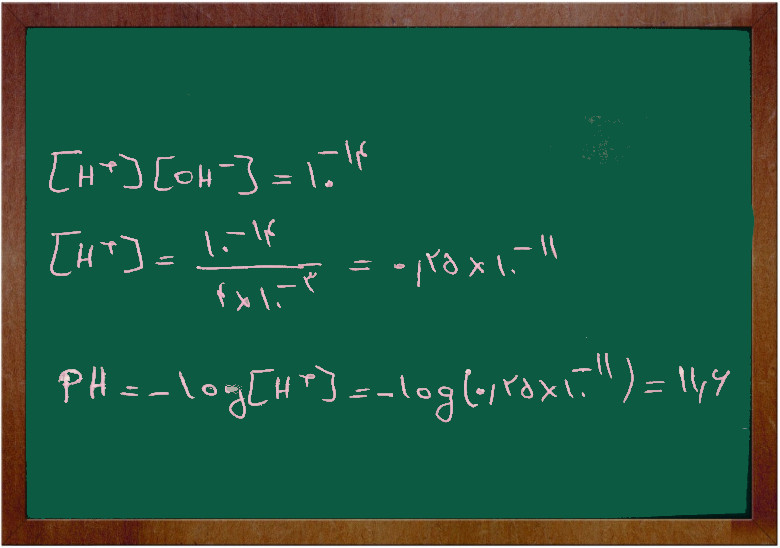اسید و باز-غلظت ها

رنگرزی سرد و گرم در خانه
اردیبهشت ۱۰, ۱۴۰۰
با هم پیل بسازیم
اردیبهشت ۱۶, ۱۴۰۰اسید و باز
تعاریف:
آرنیوس:
اسید ماده ای است که در آب (H+) تولید می کند.
باز ماده ای است که در آب (OH–) تولید می کند.
اسید
باز
برنشتد لاری:
اسید ماده ای است که پروتون (H+) می دهد.
باز ماده ای است که پروتون (H+) می گیرد.
لوئیس:
اسید ماده ای است که جفت الکترون می گیرد.
باز ماده ای است که جفت الکترون می دهد.
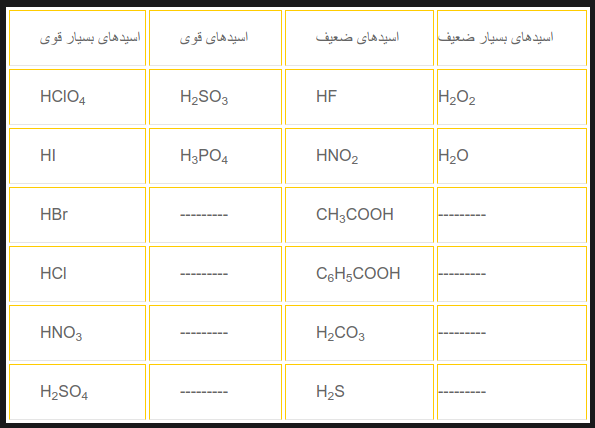
تعاریف اسید و باز قوی و ضعیف
اسید و باز قوی اسید و بازی هستند که به طور کامل تفکیک می شوند.
مثلآ هیدرو کلریک اسید یک اسید قوی است و ۱۰۰٪ تفکیک می شود.
و یا سدیم هیدرواکسید یک باز قوی است و ۱۰۰٪ تفکیک می شود.
اما استیک اسید یک اسید ضعیف است و به طور جزیی (۱/۳ ٪) تفکیک می شود.
همچنین آمونیاک یک باز ضعیف است و به طور جزیی تفکیک می شود.
توجه: در اسید و باز ضعیف جهت فلش رفت و برگشتی است.
لیست اسیدها ی قوی و ضعیف
بازهای قوی و ضعیف:
هیدرواکسید های فلزات قلیایی ، بازهای بسیار قوی ، هیدرواکسید های فلزات قلیایی خاکی نسبتآ قوی ، هیدرواکسید های بقیه ی فلزات همچنین هیدرواکسید آمونیم بازهای ضعیف هستند.
ثابت تعادل آب در دمای ۲۵ درجه مقداری است ثابت و برابر:
است.
از آنجایی که این یک عدد ثابت است با اقزایش غلظت (H+)، غلظت (OH–) تا اندازه ای کم می شود تا دوباره حاصلضرب غلظت برابر 10-14 شود.
نکته: چرا غلظت آب را در رابطه ثابت تعادل آب ننوشتیم: جواب را اینجا پیدا کنید.
مسئله ۱
اگر غلظت محلول هیدروکلریک اسید برابر با ۰/۰۱ مولار باشد غلظت یون (H+) و (OH–) را پیدا کنید.
جواب از آنجایی که هیدروکلریک اسید یک اسید بسیار قوی است و به طور کامل یونیزه می شود پس:
مسئله ۲
اگر غلظت محلول سدیم هیدرواکسید(سود سوز آور) برابر ۰/۰۰۰۱ مولار باشد غلظت یون (H+) و (OH–) را پیدا کنید.
جواب از آنجایی که سدیم هیدرو اکسید یک باز بسیار قوی است و به طور کامل یونیزه می شود پس:
درمورد اسید ها و باز های ضعیف باید درجه تفکیک(یونش)، درصد تفکیک(یونش) یا ثابت تعادل را داشته باشیم به مثال های زیر توجه کنید:
مسئله ۳
اگر غلظت استیک اسید ۰/۰۱ مولار و درصد تفکیک آن برابر ۱٪ باشد. غلظت یون (H+) و (OH–) را پیدا کنید.
جواب
در مورد استیک اسید چون یک اسید ضعیف است نمی توانیم نتیج بگیریم چون غلظت اسید ۰/۰۱ مولار است پس غلظت یون استات و یون هیدروژن هم ۰/۰۱ مولار است زیرا استیک اسید به طور کامل تفکیک نمی شود.
پس داریم:
مسئله ۴
اگر غلظت آمونیاک ۰/۰۱ مولار باشد. غلظت یون (H+) و (OH–) را پیدا کنید.
K=1.8 × 10-5
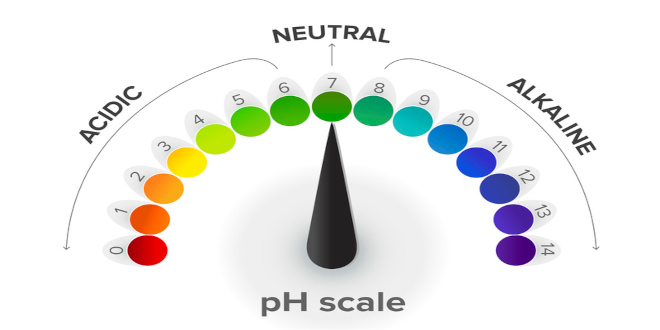
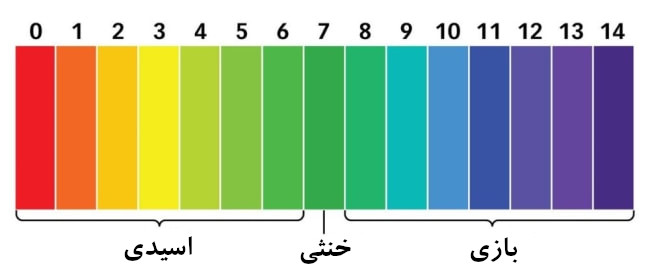
خوب تا اینجا دیدیم که در بیان غلظت های یون های هیدروژن و هیدرواکسید با اعداد کوچکی روبرو هستیم برای دوری از بیان این اعداد از پی اچ (pH) استفاده می کنیم.
محدوده پی اچ از صفر تا ۱۴ است که در آن ۷ خنثی، کمتر از ۷ اسیدی و بیش از ۷ قلیایی می باشد
فرمول اصلی پی اچ عبارت است از:
همچنین دیگر فرمول های پی اچ که در حل مسائل به کار می روند:
برای نمونه در مسئله ۱ پی اچ می شود ۲ :
پی اچ در مسئله ۲ برابر ۱۰ می شود:
مسئله ۵
محلولی شامل ۴/۲۵ گرم آمونیاک در ۲۵۰ میلی لیتر محلول موجود است. هدایت الکتریکی محلول نشان می دهد در ۲۵ درجه ۰/۴٪ از آمونیاک با آب واکنش داده است. پی اچ محلول را محاسبه کنید.