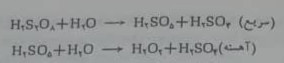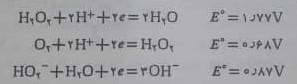تهیه هیدروژن پروکسید (H2O2)

موم
بهمن ۵, ۱۳۹۹
نانوذرات فلزی(پاورپوینت)
بهمن ۲۶, ۱۳۹۹تهیه هیدروژن پروکسید (H2O2)
هیدروژن پروکسید را می توان به روش الکترولیز که همراه با تشکیل یون پروکسودی سولفات و هیدرولیز بعدی آن است به دست آورد. سولفوریک اسیدیا محلول های سولفوریک اسید آمونیم سولفات را باشدت جریان زیاد یک آمپر بر دسی متر مربع در الکترودها معمولآ پلاتین که برای متصاعد کردن گاز اکسیژن دارای اضافه ولتاژ زیادی است، الکترولیز می کنند. اگر چه مکانیسم واکنش دقیقاً معلوم نیست ولی از نظر استوکیومتری می توان نوشت:
برای اینکه واکنش هیدرولیز (معادله ۲۴-۱) در سلول به حداقل برسد ف از واکنش های( ۲۴-۱ )
تجزیه ((معادلات۲۴-۲ الف،ب)) که موجب از بین رفتن محصول می شوند و باید جلوگیری
شود، زمان مناسبی برای باقی ماندن محلول در سلول و دمایی پایین (۲۰-) به کاربرده می شود.محلول پروکسودی سولفوریک اسید به نوبه ی خود هیدرولیز می شود:
و آب اکسیژنه را به وسیله ی تقطیر در دمای بالا وفشار پایین به سرعت جدا می کنند. سپس محلول های رقیق را که بدین ترتیب به دست آمده اند به وسیله ی تقطیر خلأ تا۳۵-۲۸درصد وزنی تغلیظ می کنند. در تجارت برای به دست آوردن باغلظت بیشتر ۹۹-۹۰ درصد تقطیر جزء به جزء چند مرحله ای به کاربرده می شود. چنانچه این آب اکسیژنه ی غلیظ در مجاورت یون های فلزی که به عنوان کاتایزور عمل می کنند قرار می گیرد،به سرعت تجزیه می شود.برای جلوگیری از این عمل لازم است به آن بازدارنده ای مانند سدیم پیرو فسفات با استانات افزود و آن را در ظرف آلومینیمی خاص(۶ر۹۹درصد) نگاهداشت.
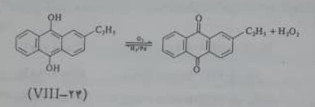
هیدروژن پروکسید همچنین به مقدار زیاد از خوداکسایش یک آنتراکینول مانند 2-اتیل آنتراکینول(۲۴-VII) در یک دور پیوسته به دست می آید.
هیدروژنی که از کراکینگ بوتان به دست می آید برای کاهش کینون در مجاورت کاتالیزور Pd، که بر روی یک حاصل بی اثر به صورت معلق قرار گرفته است، به کار می رود هیدروژن پر اکسید رااز محلول آلی اکسیژن دار- شده به وسیله ستون های با جریان معکوس استخراج می کنند، محصول آبی به دست آمده حدود 20 درصد هیدروژن پر اکسید دارد . در این روش فقط گاز هیدروژن، اکسیژن اتمسفر و آب به عنوان مواد خام لازم است . این روش از روش الکترولیز ارزان تر است. هیدروژن پر اکسید خالص ، آبی کم رنگ و مایعی شربتی شکل است در ۱۵۲/۱ درجه می جوشد و در منفی ۰/۸۹ منجمد می شود. بسیاری از خواص فیزیکی آن شبیه آب است. در ۲۵ درجه سلسیوس ثابت دی الکتریک مایع خالص ۹۳ و ثابت دی الکتریک محلول ۶۵ درصد آن در آب ۱۲۰ است. از این دو مایع خالص و محلول های آبی آن حلال های یونید کننده ی بسیار قوی هستند وکاربرد آب اکسیژنه به علت ماهیت اکسید کنندگی قوی تجربه آسان آن در مجاورت مقدار جزئی یونهای فلزات سنگین با توجه به معادله ی زیر محدود است:
در محلول های آبی رقیق آب اکسیژنه بیشتر از آب خاصیت اسیدی دارد:
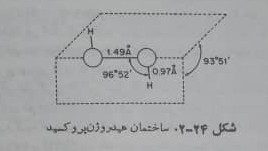
مولکول آب اکسیژنه ساختمان زنجیری و تابدار دارد(شکل۲۴-۲). فقط یک سد کوتاه نسبت به چرخش داخلی حول پیوند O-O وجود دارد. درجه ی تجمع هیدروژن پر اکسید در حالت مایع از طریق پیوند هیدروژنی به مراتب بیش از آب است.
شیمی اکسایش – کاهش هیدروژن پروکسید در محلول آبی با پتانسیل های زیر خلاص می شود:
ملاحظه می شود که هیدروژن پروکسید در محلول های اسیدی یا بازی ، عامل اکسید کننده ی قوی است ؛فقط در مقابل اکسید کننده های بسیار قوی مانند پرمنگنات به عنوان عامل کاهنده رفتار می کند.
هیدروژن پروکسید رقیق یا ۳۰درصد به طور وسیعی به عنوان اکسنده به کار می رود. اکسایش با هیدروژن پروکسید در محلول اسیدی غالباً خیلی آهسته است ، در حالی که در محلول قلیایی به سرعت انجام می گیرد. تجزیه ی هیدروژن پروکسید در محلول قلیایی ، طبق واکنش (۲۴-۳)که می توان آن را اکسایش خود به خود در نظر گرفت بسیار سریع انجام می شود ، از این رو بهتر است برای از بین بردن هیدروژن پر اکسید اضافی ، آن را در محلول قلیایی حرارت داد .
اکسایش هیدروژن پر اکسید در محلول آبی به وسیله ی گاز کلر، یون پرمنگنات، یون سریم(IV) وغیره و تجزیه ی کاتالیزوری آن به وسیله ی آهن(III)، ید، منگنز(IV)اکسید وغیره مورد مطالعه قرار گرفته است. در هردو مورد با استفاده از هیدروژن پر اکسید نشان دار معلوم شده است که اکسیژن تولید شده به طور کامل از هیدروژن پروکسید حاصل می شود نه از آب . این موضوع دلالت بر این دارد که اجسام اکسید کننده پیوند O-O را نمی شکنند بلکه به سادگی الکترون جذب می کنند در مورد اکسایش هیدروژن پر اکسید به وسیله ی کلر ، مکانیسم واکنش به دلیل عدم مبادله ی ایزوتوپ اکسیژن ۱۸ بین هیدروژن پر اکسید و آب به صورت زیر است:
در هر حال لازم است در نطر گرفته شود که در بسیاری از واکنش های شامل هیدروژن پر اکسید (همچنین اکسیژن)در محلول، رادیکال ها آزاد دخالت می کنند. در تجزیه ی کاتالیزور هیدروژن پر اکسید به وسیله ی یون فلز و سایر واکنش ها رادیکال آزاد تولید می شوند که مهمترین آنها HO2 و OH هستند. HO2 از تابش نور بر یخ در دمای پایین و همچنین در محلول های آبی که با یونهای تیتانیوم(III) ، آهن(II) و سریم(IV) واکنش می دهد ، تشخیص داده شده است.
قدرت بازی هیدروژن پروکسید بیش از یک میلیون مرتبه از هیدروژن پر اکسید کمتر است. در هر حال ، از افزایش هیدروژن پر اکسید غلیظ به تترافلوئوروبوریک اسید در تتراهیدرو تیوفن ۱،۱ـ دیوکسید(سولفولان)، کاتیونن مزدوج تری یون هیدروژن دی اکسید مثبت را می توان به دست آورد . محلول های حاصل اکسنده های بسیار قوی ولی غیر انتخابی برای بنزن ، سیکلو هگزان و سایر مواد آلی می باشند.
تایپ: امیر حسین غریبی