شناسایی یون روی-تجزیه کیفی

حقایق شیمی-بوراکس
آبان ۱۵, ۱۴۰۰
شش روش طبیعی برای کشتن موریانه
آبان ۲۷, ۱۴۰۰- آزمایش ویژگی آمفوتر روی اکسید
- آیا می توان روی کلرید و سدیم کلرید را با استفاده از از سولفید هیدروژن شناسایی کرد
- اضافه کردن NaOH رقیق به یون روی در محلول
- اضافه کردن سدیم هیدرو اکسید رقیق به یون روی
- اضافه کردن محلول آمونیاک به یون روی در محلول
- اضافه کردن هیدروژن سولفید به یون روی در محیط قلیایی
- افزودن H2S به یون روی در محیط قلیایی
- تشخیص یون روی
- چگونه روی سولفید و روی کربنات را از هم تشخیص دهیم
- چگونه روی کربنات و منیزیم کربنات را از هم تشخیص دهیم
- چگونه منیزیم اکسید و روی اکسید را با استفاده از محلول سدیم هیدرو اکسید شناسایی کنیم
- چگونه یون روی را از دیگر یون ها شناسایی کنیم
- رسوب های یون روی و رنگ آنها
- شناسایی روی کلرید و سدیم کلرید
- شناسایی یون روی
- شناسایی یون روی- تجزیه کیفی
- فلز روی
- کیان کیانی
- واکنش یون روی با محلول آمونیاک
فلز روی در دوره چهارم جدول تناوبی و در بلوک d (فلزات واسطه) قرار دارد. روی یک عنصر آمفوتر است و روی اکسید و روی هیدرواکسید هر دو ترکیبات آمفوتر هستند. روی فقط یون ۲+ تشکیل می دهد و این یک فاکتور متفاوت نسبت به دیگر فلزات واسطه دوره سوم 3d میم باشد. بیشتر فلزات واسطه دوره سوم چندین حالت اکسایش دارند.
در این درسنامه ما موارد زیر را می آموزیم.
۱- شناسایی کیفی یون روی
۲- مقایسه عملی یون روی ۲+ با دیگر کاتیون های فلزی
فلز روی
روی به طور گسترده در زمین یافت می شود و فراوانی آن همانند مس است. روی در طبیعت به شکل های سفالریت (ZnS) یا بلند روی، و اسمیتسونیت (ZnCO3). فلز روی با برشته کردن و کاهش ZnO با کربن به دست می آید. فلز روی سپید و درخشان با پرتو آبی مایل به خاکستری می باشد.
شناسایی یون روی- تجزیه کیفی
در ادامه روش های شناسایی روی معرفی می شود و سپس جزییات در این درسنامه شرح داده خواهد شد.
* تست زغال
* افزودن H2S به یون روی در محیط قلیایی
* اضافه کردن NaOH رقیق به یون روی در محلول
* اضافه کردن محلول آمونیاک به یون روی در محلول
تست زغال
یک تکه کوچک ترکیب روی را بر روی یک تکه زغال روشن قرار دهید و با یک لوله به آن بدمید در این صورت روی اکسید(ZnO) تکیل می شود.
این توده در حالت داغ قرمز است و وقتی سرد می شود سپید می گردد. آن را با کوبالت() نیترات مرطوب کنید و دوباره حرارت دهیدیک توده سبز رنگ کبالت زینکات (CoZnO2)تشکیل می شود.
اضافه کردن هیدروژن سولفید به یون روی در محیط قلیایی
اضافه کردن هیدروژن سولفید به یون روی در محیط قلیایی، رسوب سپید روی سولفید (ZnS) ایجاد می کند. محیط قلیایی بوسیلخمحلول آمونیاک ایجاد می شود.
اضافه کردن سدیم هیدرو اکسید رقیق به یون روی
اضافه کردن سدیم هیدرو اکسید رقیق به یون روی در محلول آبی یک رسوب ژلاتینی سپید روی هیدرو اکسید (Zn(OH)2) حاصل می شود. وتی مقدار بیشتری سدیم هیدرواکسید اضافه شود رسوب حل می شود و محلول بی رنگی به دست می آید.
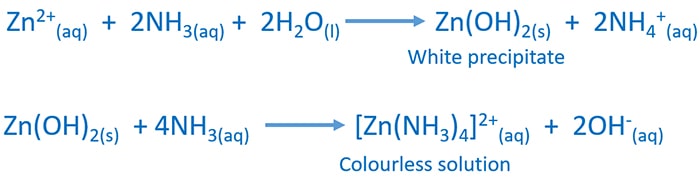
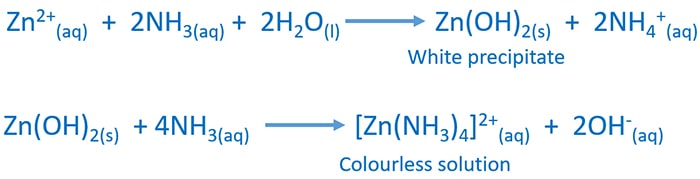
واکنش با محلول آمونیاک
اضافه کردن محلول آمونیاک به محلول آبی یون روی رسوب سپید Zn(OH)2 به دست می آید.در برابر مقدار بیشتر آمونیاک رسوب به صورت یون تترا آمین زینک(II) حل می شود.
رسوب های یون روی و رنگ آنها
روی کربنات و روی هیدرو اکسید و روی سولفید هر سه سپید می باشند.
محلول های بی رنگ یون روی
روی کلرید، روی نیترات و روی سولفات
پرسش: چگونه یون روی را از دیگر یون ها شناسایی کنیم؟
شناسایی روی کلرید و سدیم کلرید:
هردو روی کلرید و سدیم کلرید محلول های بی رنگ هستند اما شناسایی آنها بسیار آسان است. به هر دو محلول ، حلول سدیم کربنات اضافه کنید و تفاوت را مشاهده کنید. در محلول روی کلرید رسوب روی کربنات تکیل می شود. . سدیم کربنات محلول در آب می باشد.
آیا می توان روی کلرید و سدیم کلرید را با استفاده از از سولفید هیدروژن شناسایی کرد؟
بله می توانید. ابتدا هر دو محلول را با استفاده از آمونیم سولفید قلیایی کنید ثابت حلالیت روی سولفید پایین تر است. سدیم سولفید کاملآ در آب محلول است و به دلیل نا پایداری یون سولفید و هیدرولیز آن یک محلول قلیایی می دهد.
وقتی هیدروژن سولفید به هر دو محلول فرستاده می شود. در یکی از محلول ها رسوب سپید تشکیل می شود که ما می دانیم روی سولفید رسوب سپید است.
چگونه منیزیم اکسید و روی اکسید را با استفاده از محلول سدیم هیدرو اکسید شناسایی کنیم؟
در ابتدا باید بدانیم روی اکسید آمفوتر است. بنابر این روی اکسید ویژگی های یک ترکیب آمفوتر را دارد در حالی که منیزیم اکسید این ویژگی را ندارد.
هر دو ماده جامد را به آب بیفزایید ر نتیجه رسوب هر دو را می بینید، وقتی اکسید فلزات در آب ریخته می شوند هیدرواکسید تولید می شود.
آزمایش ویژگی آمفوتر روی اکسید
اکسیدهای آمفوتر هم با اسیدها و هم با بازها واکنش می دهند.
اکنون به هر دو محلول سدیم هیدرو اکسید بیفزایید، می بینید که یکی از آن ها در محلول سود حل می شود و محلول بی رنگ می دهد که آن روی اگسید است در حالی که محلول دیگر که شامل منیزیم است در سود سوز آور حل نمی شود.
چگونه روی کربنات و منیزیم کربنات را از هم تشخیص دهیم؟
هر دو را در آب حل کنید. می بینید که هر دو ته نشین می شوند و نا محلول هستند. اکنون به هر دو هیدروکلریک اسید اضافه کنید تا حل شوند. همان طور که مشاهده می کنید هرده گاز گربن دی اکسید تولید می کنند.
اکنون به هر دو محلول آمونیاک اضافه کنی تا رسوب سپید رنگ حاصل شود. با ادامه اضافه کردن محلول آمونیاک یکی از رسوب ها شروع به حل شدن می کند که آن محلول روی است که به صورت تترا آمین زینک(II) محلول در آب در می آید.
چگونه روی سولفید و روی کربنات را از هم تشخیص دهیم؟
دو پودر سپید در آزمایشگاه داریم فقط می دانیم یکی روی سولفید و دیگری روی کربنات است. چگونه این دو دودر یک شکل را از هم تشخیص دهیم؟
در هر دو ترکیب یون روی مشترک است. بنابر این باید آنیون ها( سولفید و کربنات) را آزمایش کنیم.
به هر دو هیدروکلریک اسید اضافه کنید. هر دو در این اسید حل می شوند و محلول بی رنگ می دهند. همچنین هر دو گاز می دهند.
گاز های منتشر شده هیدروژن سولفید و کربن دی اکسید است بنابراین قدم بعدی شناسایی این دو گاز می باشد.
هر دو گاز را به درون محلول کلسیم هیدرو اکسید وارد کنید. می دانیم که کربن دی اکسید با کلسیم هیدرواکسید رسوب کلسیم کربنات می دهد پس به این روش دو گاز را از هم تشخیص می دهیم.
سرچشمه:
https://www.chemistryscl.com/qualitative-analysis/testing-zinc-ion/index.php