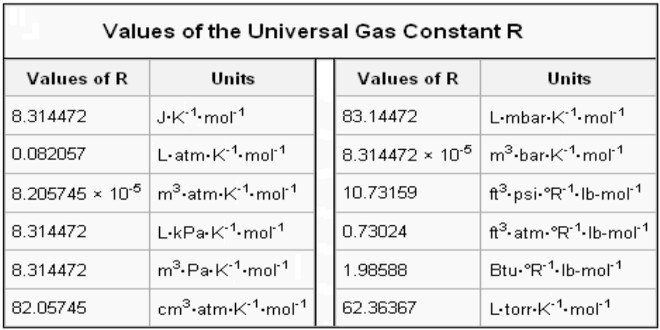
تفاوت ثابت گاز ایده آل و ثابت ویژه گازها
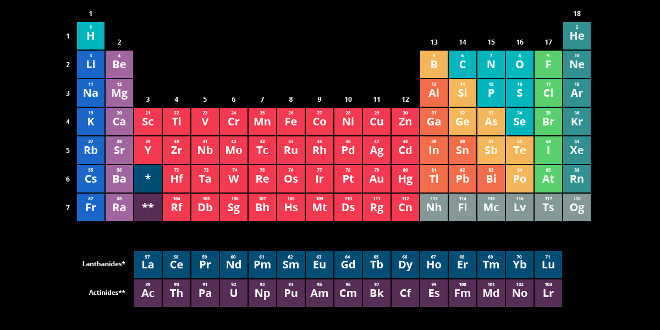
جدول تناوبی(پرسش و پاسخ)
آبان ۲۹, ۱۳۹۶
خشک کردن جامدات اصول و کاربردها
آبان ۳۰, ۱۳۹۶تفاوت ثابت گاز ایده آل(ثابت جهانی گازها) و ثابت ویژه گاز
(مطابق با گاز ایده آل صفحه ۹۱ کتاب کنترل فرایند.)
فاز گازی یکی از سه فازی است که یک ماده می تواند داشته باشد. فاز گازی قابلیت فشرده شدن بیشتری نسبت به فازهای دیگر دارد. فقط یازده عنصر جدول تناوبی در حالت عادی به صورت گاز می باشند. به هر حال “قانون گاز ایده آل” معادله ای به ما می دهد که می تواند برای توضیح رفتار گازهای نرمال به کار برود. این یک تناسب ثابت است که ثابت گاز ایده آل نامیده می شود و وقتی برای گازهای واقعی به کار می رود این ثابت باید اندکی اصلاح شود و در این صورت ثابت ویژه ی گاز نامیده می شود. کلید تفاوت بین ثابت جهانی گاز(گاز ایده آل) و ثابت ویژه ی گاز این است که ثابت جهانی گاز فقط برای گازهای ایده آل به کار می رود در حالی که ثابت ویژه ی گاز برای گازهای واقعی به کار می رود.
ثابت جهانی گاز چیست؟
مولکول های گاز به دلیل این که بسیار سبک هستند، قابلیت حرکت آزادانه در فضا را دارد. نیروی بین مولکولی گازها نیروی ضعیف واندروالس می باشد. به هر حال برای توضیح رفتار یک گاز، دانشمندان بر اساس یک گاز فرضی تئوری ارائه کرده اند که به عنوان گاز ایده آل شناخته شده است.
ابتدا باید بدانیم یک گاز ایده آل به چه معنی می باشد. این یک گاز فرضی است که اگر واقعی بود ویژگی های زیر را از خود نشان می داد.
* یک گاز ایده آل ترکیبی از مقادیر بسیاری از مولکول های کوچک گاز است.
* حجم این مولکول های گاز ناچیز است.
* هیچ جاذبه ای بین مولکول های گاز وجود ندارد.
* حرکت مولکول های گاز از قانون نیوتن درباره حرکت پیروی می کند.
* برخورد مولکول ها کاملآ کشسان(استاتیک) است.
با نگاه به این ویژگی ها، معلوم است که هیچ گاز واقعی ایده آل نیست.
قانون گازهای ایده آل
قانون گاز ایده آل حالت گاز ایده آل را نشان می دهد و معادله ی آن به صورت زیر است.
PV = nRT
P-فشار گاز ایده آل
V- حجم گاز ایده آل
n- تعداد مولکول گاز ایده آل(مقدار ماده)
T- دما
حرف R ثابت جهانی گاز هاست. مقدار R با توجه به دماو فشار استاندارد که صفر درجه سانتی گراد و فشار یک اتمسفر است، محاسبه می شود. در این حالت مقدار R برابر ۰/۰۸۲.۵۷ لیتر بر کلوین ضربدر مول می باشد.
ثابت ویژه گاز چیست؟
وقتی معادله گاز ایده آل برای گاز های معمولی به کار می رود، معادله ی بالا باید اصلاح شود زیرا هیچ گاز واقعی همانند گاز ایده آل رفتار نمی کند. بنابر این ثابت ویژه ی گاز، در عوض ثابت جهانی گازها به کار می رود. ویژگی های گازهای حقیقی که متفاوت با گازهای آیده آل هستند به صورت زیر می باشد.
* گازهای حقیقی ترکیبی از مولکول های بزرگ تری در مقایسه با گازهای ایده آل می باشد.
* مولکول های این گاز حجم معینی دارد.
* نیروی واندروالس ضعیفی بین مولکول های گاز وجود دارد.
* برخوردها کشسان(استاتیک) نیست.
بنابر این قانون گازهای ایده آل نمی تواند مستقیمآ برای گازهای حقیقی به کار برود. به همین علت یک اصلاح ساده ای انجام می شود. برای این منظور ثابت جهانی گاز ها تقسیم بر جرم مولکولی گاز می شود.
R(ویژه)= R/M
ثابت ویژه گاز =R(ویژه)
R = ثابت جهانی گاز
M = جرم مولی گاز
این رابطه حتی برای مخلوط گازها هم به کار می رود. در این حالت ثابت R بر جرم مولکولی مخلوط تقسیم می شود. این ثابت گاز، با عنوان ثابت ویژه ی گاز شناخته می شود زیرا مقدار آن بستگی به نوع گاز یا مخلوط گاز دارد.
تفاوت بین ثابت جهانی گاز و ثابت ویژه ی گاز
-ثابت جهانی گازها برای گازهای ایده آل و ثابت ویژه ی گاز برای یک گاز واقعی به کار می رود.
-ثابت جهانی گازها با استفاده از دما و فشار استاندارد (STP) محاسبه می شود و ثابت ویژه ی گاز با مقادیر STP همراه با جرم مولی گاز واقعی محاسبه می شود.
-ثابت جهانی گاز مستقل از گاز است اما ثابت ویژه ی گاز بستگی به نوع گاز دارد.
– مقدار ثابت جهانی گاز برابر ۰/۰۸۲۰۵۷ می باشد اما مقدار ثابت ویژه ی گاز بستگی به نوع گاز دارد.
خلاصه:
یک گاز ایده آل یک گاز فرضی است که فرض گرفته شده است که خواص آن بسیار متفاوت نسبت به گاز واقعی است. قانون گاز ایده آل برای توضیح رفتار یک گاز ایده آل معرفی شده است. هرچند برای استفاده از این ثابت برای گازهای واقعی، باید ثابت گاز واقعی را به جای ثابت جهانی گازها به کار برد. و این به خاطر این است که هیچ گاز واقعی شبیه گاز ایده آل رفتار نمی کند. تفاوت اصلی ثابت جهانی گاز ها و ثابت گازهای واقعی این است که ثابت جهانی گاز برای کازهای ایده آل و ثابت ویژه ی گاز برای گازهای واقعی به کار می رود.
برگردان: کیان کیانی
سرچشمه
Difference Between Universal Gas Constant and Characteristic Gas Constant
برای مطالعه ی ادامه ی مطلب در وبسایت دبیرخانه راهبری صنایع شیمیایی بر روی همین متن کلیک کنید.