نکات اکسایش کاهش

اسپری ضد بخار عینک
آبان ۲۶, ۱۳۹۹
تدریس شیمی با نگاه کاربردی
آذر ۲۴, ۱۳۹۹- ارزش حجمی
- اکسید کننده های قوی
- انواع واکنش های اکسایش کاهش
- پی اچ آب اکسیژنه
- تسهیم نامتناسب
- تعریف واکنش اکسایش کاهش
- تهیه آب اکسیژنه
- تهیه آب اکسیژنه بررسی خواص آن
- تهیه آزمایشگاهی آب اکسیژنه
- تهیه صنعتی آب اکسیژنه
- قواعد تعیین عدد اکسایش
- محاسبه اکی والان حجمی
- مواد اکسید کننده
- موارد استعمال آب اکسیژنه
- موازنه اکسیژن و هیدروژن به ویژه در نیمه واکنشها
- نکات اکسایش کاهش
نکات اکسایش کاهش:
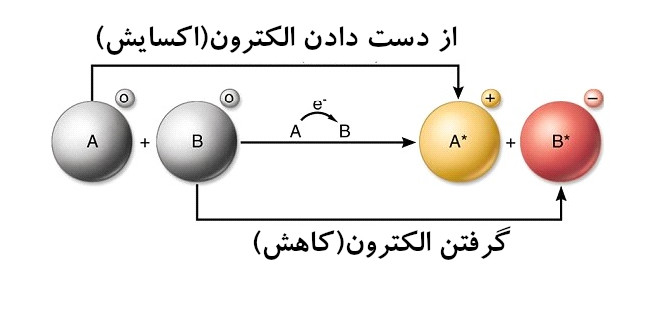
– تعریف اکسایش کاهش
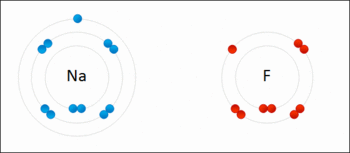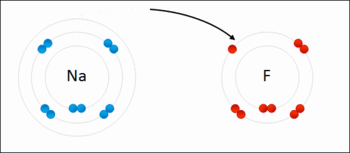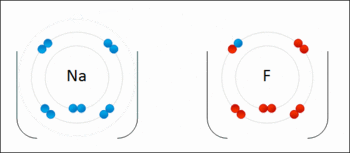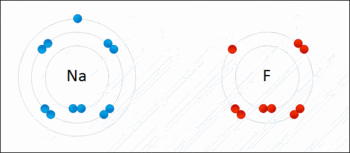
اکسایش: هر ذره ای که الکترون از دست بدهد اکسید می شود.
کاهش: هر ذره ای که الکترون بگیرد کاهش یافته یا احیا می شود.
تعریف عدد اکسایش:
عدد اکسایش یک اتم، باری است که به طور قراردادی به یک اتم در یک ترکیب نسبت داده می شود، به اتم الکترونگاتیو تر بار منفی و به اتم الکتروپوزتیو تر بار مثبت تعلق می گیرد.
تعاریف دیگر عدد اکسایش:
عدد اکسایش عناصر برابر واحدهای بار الکتریکی است که بر طبق قواعد قراردادی (که توسط پاولینگ وضع شده است) برای آنها در نظر گرفته می شود.
عدد اکسایش باری است که اگرالکترون هامشترک نبودند ولی به طور کامل منتقل میشدند، آن اتم دارا می بود. بدین ترتیب عدد اکسایش هرعنصر درترکیب یونی دوتایی برابر بار یونی است. هر
چند عدد اکسایش برای هر عنصر درترکیب کووالانسی یا یون چنداتمی واضح نیست.زیرا اتم بار کامل ندارد.
قواعد تعیین عدد اکسایش:
۱- همه ی عناصر در حالت آزاد عدد اکسایش صفر دارند.
Cu=0
Cl2=0
۲- عدد اکسایش یون های منفرد برابر بار آن یون می باشد.
Cu2+ = +2
Cl– = -1
۳- عدد اکسایش فلزات قلیایی (Li, Na, K, Rb ….) همیشه در همه ی ترکیبات مثبت یک و عدد اکسایش فلزات قلیایی خاکی (Be, Mg, Ca, Sr, Ba….) همیشه در همه ی ترکیبات مثبت دو می باشد.
۴- هیدروژن همیشه در همه ی ترکیبات برابر مثبت یک (HCl, H2O….) ، بجز در هیدرید های فلزات قلیایی و قلیایی خاکی (KH, BaH2….) که در آن ها منفی یک می باشد.
۵- اکسیژن همیشه در همه ی ترکیبات برابر منفی دو (HNO3 , H2O) ، به جز پر اکسید ها (Na2O2 , H2O2) که در آن ها منفی یک ، در سوپر اکسید ها (KO2) منفی یک دوم و در اوزونید ها (KO3) منفی یک سوم می باشد. و فقط در فلئورید اکسیژن (OF2) برابر مثبت ۲ می باشد.
۶- هالوژن ها فقط در هالید ها (NaCl , CaF2, KI, ….) منفی یک می باشد.
۷- عدد اکسایش همه فلزات در ترکیب همواره مثبت و در حالت آزاد صفر است.
۸- جمع جبری اعداد اکسایش در یک ترکیب برابر بار آن ترکیب می باشد.
——————————
تعریف واکنش اکسایش کاهش: واکنشی است که در آن یک یا چند اتم الکترون از دست داده اکسید و یک یا چند اتم الکترون گرفته کاهش می یآبد.
واکنش زیر غیر اکسایش-کاهش است چون هیچ اتمی تغییر درجه نیافته.
NaOH + HCl → NaCl + H2O
واکنش اکسایش کاهش ، چون سدیم و هیدروژن تغییر درجه یافته اند.
Na + H2O → NaOH + H2
——————————
انواع واکنش های اکسایش کاهش:
نوع اول: یک ماده کاملآ اکسید و یک ماده کاملآ کاهش می یآبد در این نوع بهتر است آبتدا در طرف اول تغییر درجات را جابه جا کنیم
Sn4+ + Fe2+ → Sn2+ + Fe3+
نوع دوم: یک قسمت از اتم ها تغییر درجه یافته قسمت دیگر از همان اتم بدون تغییر باقی می ماند، در این نوع تغییر درجات را باید آبتدا در طرف دوم جابه جا کنید. در مثال زیر نیتروژن اسید نیتریک یک بار از مثبت پنج به مثبت چهار در نیتروژن دی اکسید تغییر کرده و یک بار در مس (II)نیترات بدون تغییر باقی مانده است.
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
نوع سوم: اتواکسیداسیون یا تسهیم نامتناسب، در این نوع یک عنصر هم اکسید شده هم کاهش یافته در این نوع نیز باید آبتدا تغییر درجات را در طرف دوم جابه جا کنید.
Cl2 + NaOH → NaCl + NaClO3 + H2O
مگر این که وا کنش تسهیم به صورت وارونه باشد، یعنی یک عنصر در طرف اول با دو درجه اکسایش مختلف به یک درجه اکسایش برسند. در مثال زیر ید یک بار از یدات مثبت پنج و یک بار از ید منفی یک به ید مولکولی صفر رسیده اند
IO3– + I– + H+ → H2O +I2
در یک واکنش اکسایش کاهش، اگر عنصری که تغییر درجه یافته، بیش از یک عدد باشد، باید تغییر درجه در تعداد عنصر ضرب شود (به جز واکنش تسهیم نامتناسب) یک واکنش نه تنها از نظر عنصر و یون باید موازنه باشد، از نظر بار نیز باید موازنه
باشد. از این نکته نه تنها در چک کردن درستی موازنه می توانید استفاده کنید مواقعی که در موازنه ی عناصر و عواملی که تغییر درجه نیافته اند دچار مشکل شدید و به بن بست رسیدید این نکته راه گشا خواهد بود.
مواد اکسید کننده: موادی هستند که از مواد دیگر الکترون می گیرند آنها را اکسید می کنند و خود کاهش می یآبند. معمولآ ترکیباتی که یکی از عناصر آنها به بالا ترین درجه اکسایش خود رسیده باشد اکسید کننده قوی می باشند.( بالاترین درجه اکسایش برای یک عنصر برابر شماره گروه آن می باشد)
برخی اکسید کننده های قوی
HNO3 نیتریک اسید
K2Cr2O7 پتاسیم دی کرومات
KMnO4 پتاسیم پرمنگنات
مواد کاهنده یا احیا کننده: موادی هستند که به مواد دیگر الکترون داده آن ها را کاهش می دهند و خود اکسید می شوند. برخی از کاهنده های قوی عبارتند از فلزات قوی ( قلیایی و قلیایی خاکی)، هیدروژن، ….
موازنه اکسیژن و هیدروژن به ویژه در نیمه واکنشها:
برای موازنه اکسیژن و هیدروژن ، در محیط اسیدی هر طرف اکسیژن کم داشته باشیم به همان تعداد آب اضافه می کنیم و به طرف مقآبل دو برابر تعداد آب یون هیدروژن می افزاییم.
نمونه:
Cr2O72- + 6e– → 2Cr3+
در نیمه واکنش بالا که در محیط اسیدی انجام شده، هفت اکسیژن طرف دوم کم داریم، پس هفت آب طرف دوم و چهارده یون هیدروژن به طرف اول می افزاییم:
Cr2O72- + 6e– + 14H+ → 2Cr3+ + 7H2O
نگاه کنید، اکنون در نیمه واکنش بالا دو طرف نه تنها از نظر عنصر و یون بلکه از نظر بار نیز موازنه است و این نشان می دهد عمل موازنه به درستی انجام شده. همیشه پس از اتمام موازنه بار دو طرف را بررسی کنید.
در محیط قلیایی هر طرف اکسیژن کم داشته باشیم، دو برابر تعداد مورد نیاز یون هیدرواکسید منفی و به طرف مقآبل نصف تعداد هیدرواکسید ، آب می افزاییم.
برای نمونه:
Cl° → ClO3– + 5e–
Cl° + 6OH– → ClO3– + 5e– + 3H2O
اکنون واکنش بالا را از نظر بار برسی کنید؟
ارزش حجمی:
در مورد واکنش های گازی شکل یا واکنش هایی که گاز تولید می کنند از ارزش حجمی برای بیان غلظت استفاده می کنند.
تعریف ارزش حجمی a:
مقدار گازی که در شرایط استاندارد از یک لیتر محلول آزاد می شود.
a = N.Ev
در فرمول بالا N ، نرمالیته و Ev اکیوالان حجمی است.
محاسبه اکی والان حجمی:
Ev = V/n
در رآبطه ی بالا V حجم و n ظرفیت و یا تغییر درجه می باشد. مثلآ در مورد آب اکسیژنه:
H2O2– → H2O2- + 1/2 O20
همانطور که مشاهده می شود اکسیژن یک بار از منفی یک به صفر و یک بار از منفی یک به منفی دو تغییر درجه پیدا کرده پس هر اتم اکسیژن یک درجه و در مجموع دو درجه تغییر کرده پس اکی والان حجمی آن در شرایط استاندارد برابر
Ev = 11.2/2 = 5.6 Lit
بنآبراین هرگاه ارزش حجمی محلولی از هیدروژن پر اکسید برابر ۵/۶ باشد، یک لیتر محلول آن توانایی آزاد کردن ۵/۶ لیتر گاز اکسیژن(در شرایط استاندارد) را داشته و چنین محلولی نرمال به شمار می رود.
نمونه
ارزش حجمی آب اکسیژنه دو نرمال را پیدا کنید.
a = N.Ev
a = 2 × 5.6 = 11.2 Lit
یعنی ارزش حجمی آب اکسیژنه ۲ نرمال برابر ۱۱/۲ لیتر است بنآبراین هرلیتر از این محلول ۱۱/۲ لیتر گاز اکسیژن در شرایط استاندارد تولید می کند.
نمونه ۲
۲۰ سی سی از یک محلول هیدروژن پراکسید در مجاورت سولفوریک اسید، می تواند ۴۰ سی سی محلول نرمال پتاسیم پرمنگنات را بی رنگ کند. معادله واکنش را بنویسید. همچنین نرمالیته و ارزش حجمی هیدروژن پر اکسید را حسآب کنید.
2KMnO4 + 5H2O2 + 3H2SO4 → 5O2 + 2MnSO4 + K2SO4 + 8H2O
N1V1 = N2V2
N1 × 20 = 2 × 40
N1 = 4N
a = N.Ev
a = 4 × 5.6
a = 22.4 Lit
بیشتر بدانید:
تهیه آب اکسیژنه بررسی خواص آن
خصوصیات آب اکسیژنه
به مرور آب اکسیژنه تجزیه و تبدیل به آب واکسیژن میگردد. این عمل تجزیه در محیط بازی سریع تر و محیط اسیدی کندتر تا در محیط خنثی صورت میگیرد. ممکن است که اگر مدت مدیدی آب اکسیژنه را انبار کنند، کاملا تجزیه و تبدیل به آب گردد. بر اثر گرد بعضی اجسام عمل تخریب آب اکسیژنه تسریع میگردد مانند گرد بیاکسید منگنز و گرد فلزات و …
اگر بر روی محلول آب قدری از اجسام پایدار کننده مانند اسید فسفریک، اوره، اسید بنزوئیک و نظیر آن ها بیافزایند، عمل تخریب بسیار کند
میگردد. آب اکسیژنه اثر میکروب کشی و بوبری دارد چنانکه اگر یک تکه کالباس قرمز را درون ظرف محتوی آب اکسیژنه قرار دهیم پس از چند روز محتویات ظرف کاملا بیبو است و بوی گندیده نمیدهد. آب اکسیژنه رنگ ها را نیز تخریب میکند به همین دلیل تکه کالباس درون ظرف بعد از مدتی بیرنگ میشود
آب اکسیژنه خالص مایعی است بی رنگ که در بسیاری از خواص فیزیکی به آب شباهت دارد و حتی میزان تجمع آن از طریق پیوند هیدروژنی بیشتر بوده و ۴۰% از آب سنگینتر است. آب اکسیژنه دارای ثآبت دیالکتریک بالا است و لیکن کاربرد آن به عنوان حلال یونیزه کننده به واسطهی خاصیت اکسندگی قوی و تجزیهی سریع آن در حضور حتی مقادیر جزئی از یون های فلزات سنگین طبق واکنش زیر، محدود میشود:
H2O2 → 2H2O + O2
ΔH = -99 kj/mol
در محلول آبی رقیق، آب اکسیژنه بیشتر از آب خاصیت اسیدی دارد:
H2O2 → H++2OH– K = 1.5 × 10-12
مولکول آب اکسیژنه دارای ساختمان زنجیری تابدار است.
شیمی واکنش های اکسایشی – کاهشی H2O2
در محلول آبی با پتانسیل های زیر خلاصه میشود:
H2O2 + 2H+ + 2e– → 2H2O
E= 1.77V
O2 + 2H+ + 2e– → H2O2E = 0.68V
HO2- + H2O + 2e– → 3OH– E= 0.87Vاین پتانسیل ها نشان میدهند که آب اکسیژنه هم در محیط اسیدی و هم در محیط بازی اکسندهای بسیار قوی است و آب اکسیژنه فقط در مقابل اکسندههای بسیار قوی مثل یون منفی MnO4– نقش کاهندگی دارد.
محلول های رقیق یا ۳۰% آب اکسیژنه، به طور وسیعی به عنوان اکسنده مورد استفاده قرار میگیرند. عمل اکسایش به وسیله آب اکسیژنه در محیط اسیدی
کند است، در حالی که در محیط بازی معمولا” سریع است. تجزیه آب اکسیژنه به آب و O2 که ممکن است به عنوان خود اکسایش در نظر گرفته شود، در محیط بازی با سرعت بیشتر انجام میشود، بنابراین بهترین روش برای از بین بردن مقادیر اضافی H2O2 ، گرما دادن آن در محیط بازی است.
موارد استعمال آب اکسیژنه
از آنجایی که آب اکسیژنه بوبر است در موقع معالجه زخم های بدبو مورد استعمال قرار میگیرد.
همچنین لکه شراب قرمز و خون و قهوه و غیره را هم میتوان بوسیله آب اکسیژنه پاک نمود. در قرص های اریتزون آب اکسیژنه به اوره متصل است و چون این قرص ها را در دهان بگذارند، اکسیژن میدهد. پس هم میکروب های دهان را میکشد و هم دندان ها را سفید مینماید.
بسیاری از خمیر دندان ها و سایر اجسامی که برای پاک کردن دندان ها بکار میرود در موقع استعمال تولید آب اکسیژنه میکنند و اکسیژن این آب اکسیژنه دندان را سفید مینماید.
آب اکسیژنه در بیرنگ کردن شاخ ، پشم گوسفند پنبه کنف ، کاه ، چوب کاغذ روغن ابریشم، عاج ، پر و غیره بکار میرود. رنگ بعضی لکههای صورت را هم آب اکسیژنه تخریب میکند. اگر موی سیاه را پس از شستن با کربنات سدیم ( تا چربی آن برطرف شود ) در محلول آب اکسیژنه بگذارند به رنگ روشن در میآید.
اگر موی سیاه سر را با مخلوطی از ۱۰۰ گرم آب اکسیژنه ۳۰% و چهار قطره محلول آمونیاک تر نمایند و پس از ۱۰ تا ۲۰ دقیقه با آب خالص و سپس با محلول اسید استیکدار بشویند، بور مایل به قرمز میشود.
وجود آمونیاک از این جهت لازم است که آب اکسیژنه در حضور قلیایی ها سریع تر اکسیژن میدهد و در نتیجه موها تندتر بور میشوند. مصرف مکرر آب اکسیژنه برای مو مضر است زیرا که مو را شکننده مینماید. در جنگ جهانی آب اکسیژنه ۸۵%برای اکسیداسیون سریع الکل در زیر دریایی ها و موشک ها مصرف میکردند. آب اکسیژن رقیق را برای قرقره کردن هم بکار میبرند. شناسایی آب اکسیژنه
در یک لوله آزمایشی که قبلا چند سانتیمتر مکعب محلول بیکرمات پتاسیم و قدری اسید سولفوریک رقیق ریختهایم آب اکسیژنه میافزاییم در نتیجه رنگ آبی تند که بعدا تبدیل به سبز میشود، ظاهر میگردد. به همین طریق میتوان وجود آب اکسیژنه را در اریتزن ثآبت نمود
تهیه آب اکسیژنه و بررسی برخی از خواص آن
اولین بار آب اکسیژنه به وسیله آقای تنارد در سال ۱۸۱۸ تهیه شد. وی با اسیدی کردن پراکسید باریم و خارج کردن آب اضافی از طریق تبخیر در خلاء موفق به تهیه آب اکسیژنه شد.
پراکسید مشتقات پراکسید هیدروژن است که در آن به جای هر هیدروژن یک فلز یک ظرفیتی و یا دو ظرفیتی وجود دارد. پراکسید فلزات قلیایی و قلیایی خاکی به ترتیب دارای فرمول M2O2 و MO2 می باشند.
پراکسید ها به دو دسته تقسیم می شوند:
۱) پلی اکسید ها که با اسید سولفوریک تولید اکسیژن می کنند.
۲) هیپراکسید ها که با اسید سولفوریک رقیق تبدیل به آب اکسیژنه می شوند. به این دسته نمک های آب اکسیژنه می گویند.
از موارد استفاده آب اکسیژنه می توان به اثر سفید کنندگی در الیاف سلولزی و پارچه ها، ضدعفونی کنندگی و همچنین تولید برخی از مواد شیمیایی اشاره کرد.
آب اکسیژنه خالص تقریباً بی رنگ و در برخی موارد آبی کم رنگ به نظر می آید. دمای ذوب و جوش آن به ترتیب ۸۹-°C و ۱۵۰°C می باشد. در ۲۰°C در حالت مایع دارای دانسیته ۱/۴۳۸ است. در آب و الکل و اتر به هر نسبتی حل می شود. درجه اکسیداسیون اکسیژن در آب اکسیژنه برابر ۱- است. معمولاً پراکسید هیدروژن به صورت محلول ۶% ، ۱۲% و یا ۳۰% آن بیان می گردد که معمولاً به صورت پراکسید هیدروژن ۲۰ حجم، ۴۰ حجم و یا ۱۰۰ حجم نیز گفته می شود. ثابت دی الکتریک آب اکسیژنه بالا می باشد. مایع خالص آن در دمای 25°C ، ε=۹۳ و محلول آبی ۶۰% آن ε=۱۲۰ می باشد. بنآبراین ترکیب جزء حلال های یونی کننده خیلی خوبی هستند ولی به علت قدرت اکسید کنندگی زیاد و نا پایداری، قدرت حل کنندگی آن ها محدود است. محلول مایع آب اکسیژنه به مرور طبق واکنش زیر به آب و اکسیژن تبدیل می شود.
2H2O2 → O2 + 2H2O
در غیاب کاتالیزور سرعت تجزیه آب اکسیژنه بسیار ملایم است ولی در مقابل فلزاتی چون Pt ، Ag و یا ترکیباتی چون
MnO2واکنش شدت می گیرد و به همین دلیل آب اکسیژنه را در ظروف غیر فلزی همراه با یک پایدار کننده مانند اوره نگه داری می کنند. برای پایدار کردن، آن را با موادی از قبیل اسید فسفریک، اسید سیتریک و گلیسرول که خاصیت ضد کاتالیزوری دارند، مخلوط می کنند. خاصیت اکسید کنندگی آب اکسیژنه به علت سهولت آزاد شدن یک اتم اکسیژن فعال است.
H2O2 → O + H2O
آب اکسیژنه به صورت یک اکسید کننده و یا احیا کننده در محیط های اسیدی و بازی می تواند به کار رود.
احیا کننده در محیط اسیدی:
2KMnO4 + 3H2SO4 + 5H2O2 → K2SO4 + 2MnSO4 + 8H2O + 5O2
اکسید کننده در محیط اسیدی:
2[Fe(CN)6]4- + H2O2 + 2H+ → 2[Fe(CN)6]3- + 2 H2O
کاهنده (احیا کننده) در محیط بازی:
2[Fe(CN)6]3- + H2O2 + 2OH– → 2[Fe(CN)6]4- + 2H2O + O2
اکسید کننده در محیط بازی:
Mn2+ + H2O2 → Mn4+ + 2OH–
سولفور سرب سیاه رنگ در سرما تحت اثر H2O2 به سولفات سفید رنگ تبدیل می شود.
4H2O2 → 4O + 4H2O
PbS + 4O → PbSO4
روش تهیه آزمایشگاهی آب اکسیژنه
پراکسید هیدروژن را می توان از اثر اسید سولفوریک رقیق بر پراکسید سدیم یا پراکسید باریم (BaO2.8H2O) در دمای پایین تهیه کرد.
H2SO4 + BaO2 → BaSO4 + H2O2
در تهیه نمک های باریم از باریت ها (BaSO4) مقداری BaO به دست می آید که در اثر حرارت در هوا اکسید می شود و به پراکسید باریم تبدیل می شود. پراکسید باریم با اسید فسفریک نیز تولید آب اکسیژنه می کند.
BaO2 + H3PO4 → BaHPO4 + H2O2
فسفات باریم نا محلول از آن جدا می شود و محلول آبی آب اکسیژنه به دست می آید که به وسیله تقطیر در فشار کم می توان آن را تغلیظ کرد. از عبور گاز دی اکسید کربن در محلول پراکسید باریم نیز آب اکسیژنه بدست می آید.
BaO2 + H2O + CO2 → BaCO3 + H2O2
روش دیگر بر اساس روش مرک می باشد که در آن پراکسید سدیم با اسید سولفوریک ۲۰% در دمای پایین واکنش داده و بعد از خارج کردن سولفات سدیم متبلور (Na2SO4.10H2O) بعد از تغلیظ آب اکسیژنه با غلظت ۳۰% بدست می آید.
Na2O2 + H2SO4 + 10H2O → Na2SO4.10H2O + H2O2
روش تهیه صنعتی آب اکسیژنه
فرایند خود اکسایش: یکی از مشتقات آنتراکینون بر اثر واکنش با هیدروژن در مجاورت کاتالیزگر پالادیم به آنتراهیدروکینون تبدیل می شود. با عبور هوا از این ماده، محلول پراکسید هیدروژن ۲۰% وزنی به دست می آید.
روش الکترولیز: از الکترولیز محلول اسید سولفوریک ۵۰% وزنی یا محلول اسید سولفوریک و سولفات گمونم با شدت جریان زیاد، پراکسو دی سولفات (و در نهایت از هیدرولیز آن پراکسید هیدروژن) در آند و هیدروژن در کاتد بدست می آید.
H2SO4 ⇌ H+ + HSO4–
2HSO4– → H2S2O8 + 2 e–
H2S2O8 + H2O → H2SO5 + H2SO4
H2SO5 + H2O → H2SO4 + H2O2
پراکسید هیدروژن را در دمای بالا و فشار کم جداکرده و پس از تغلیظ سازی، محلول ۳۰% وزنی بدست می آید.
روش کار:
مقدار ۱۲/۵ میلی لیتر اسید سولفوریک ۲۰ درصد را در حمام آب یخ قرار می دهیم تا سرد شود و بعد به مقدار ۲/۵ گرم پروکسید باریم را به تدریج به اسید سرد اضافه می کنیم بعد از آن به محلول ۰/۵ گرم کربنات باریم اضافه می کنیم محلول را در حمام آب سرد قرار می دهیم تا کاملا ً سرد بشود بعد محلول را صاف می کنیم زیر صافی را که آب اکسیژنه است نگه می داریم .
BaO2 + H2SO4 → H2O2 + BaSO4
طرز شناسایی آب اکسیژنه
مقدار کمی از پودر MnO2 را در یک لوله آزمایش می ریزیم و به آن قطره قطره آب اکسیژنه را اضافه می کنیم که بر اثر این فرایند از لوله آزمایش حباب خارج می شود.
یک روش خوب برای شناسایی پراکسید هیدروژن استفاده از پرمنگنات در محیط اسیدی است.
2MnO4– + 5H2O2 + 6H+ → 2Mn2+ + 5O2 + 8H2O
در شناسایی پراکسید هیدروژن به وسیله پرمنگنات باید مراقب باشیم تا دی اکسید منگنز به وجود نیاید. زیرا MnO2 به صورت کاتالیزور عمل کرده و پراکسید هیدروژن را تجزیه می کند. جهت رفع این مشکل باید محلول به حد کافی اسیدی باشد و همچنین پرمنگنات را خیلی آهسته به محلول پراکسید هیدروژن اضافه نمود
2KMnO4 + 3H2SO4 + 5H2O2 → K2SO4 + 2MnSO4 + 8H2O + 5O2
مقدار ۱میلی لیتر از محلول پتاسیم یدید را در یک لوله آزمایش ریخته ومحیط را اسیدی می کنیم و به آن قطره قطره آب اکسیژنه اضافه می کنیم تا رنگ محلول زرد یا قهوهای شود وبا استفاده از معرف چسب نشاسته وجود ید را در محلول شناسایی می کنیم رنگ محلول به رنگ آبی و به علت ناپایداری به قهوهای تیره تغییر رنگ میدهد.
2KI + H2SO4 + H2O2 → K2SO4 + I2 + 2 H2O
مقداری پودر سولفات آهن را در آب مقطر حل می کنیم وبعد محیط را اسیدی می کنیم و به محلول آب اکسیژنه را اضافه می کنیم و شناسا گر
[Fe(CN)6]4-
را به محلول اضافه می کنیم تا رنگ محلول به رنگ آبی تغییر رنگ دهد.
2[Fe(CN)6]4- + H2O2 + 2H+ → 2[Fe(CN)6]3- + 2H2O
FeSO4+H2O2+H2SO4 → Fe2(SO4)3 +2H2O
۱) pH آب اکسیژنه چیست؟
آب اکسیژنه به صورت یک اسید ضعیف عمل کرده زیرا ثابت یونیزاسیون آن بسیار پایین بوده و تا حدودی شبیه آب است محلول خالص آب اکسیژنه و تا حد زیادی محلول خالص و اسیدی شده آب اکسیژنه را منحصرا بحالت یونیزه نشده (فعال نشده ) آب اکسیژنه اطلاق می کنند.
pH آب اکسیژنه صنعتی کمتر از ۳ می باشد و بشرط انکه pH ان را تا حد پایین تر نگه داریم پایداری محصول در حرارت بالا بسیار خوب خواهد بود .۲ ) نرمالیته و ارزش حجمی آب اکسیژنه را چگونه می توان تعیین کرد؟
قدرت پراکسید هیدروژن (ارزش حجمی) عبارت است از حجم اکسیژن که در شرایط متعارفی از یک حجم پراکسید هیدروژن آزاد می شود. مثلاً اگر ۱۰gr پراکسید هیدروژن در شرایط متعارفی تولید ۲۰۰ml اکسیژن کند، ارزش حجمی این محلول ۲۰ خواهد بود. ارتباط ارزش حجمی پراکسید با نرمالیته آن به صورت زیر می باشد.
a = N × 5.6
که در آن a ارزش حجمی و N نرمالیته می باشد
۳)واکنش های زیر را به صورت موازنه شده بنویسید.
Fe2+(aq) + H2O2 + H+(aq) → Fe3+(aq) + H2O(l)
NaOCl + H2O2 → O2 + NaCl + H2O
KMnO4 + H2O2 → MnO2 + KOH + H2O + O2
Na2B4O7 + H2O2 + NaOH → Na2B2O4(OH)4 + H2O
اپلیکیشن اکسایش کاهش شامل نکات اکسایش کاهش، نکات پیل، و نکات الکترولیز و همچنین ۱۵۰ تست تعاملی را از اینجا دانلود و نصب کنید.