نکات کنکوری شیمی ۲۱(واکنش مس با نیتریک اسید)

ملاحضاتی در ساخت مواد رنگ زا
فروردین ۱۵, ۱۳۹۷
آموزش نرم افزار مستر نوا MestreNova
فروردین ۱۸, ۱۳۹۷واکنش مس با نیتریک اسید رقیق و غلیظ کمی متفاوت است
اگر مس با نیتریک اسید رقیق واکنش دهد گاز بی رنگ NO حاصل می شود طبق واکنش زیر:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
و اگر مس با نیتریک اسید غلیظ واکنش دهد گاز خرمایی رنگ NO2 به دست می آید طبق واکنش زیر:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
اگر موازنه ی واکنش های بالا را تاکنون نیاموخته اید اپلیکیشن اکسایش کاهش را از مارکت کیان دروید یا بازار دانلود و مطالعه کنید و تست ها و تمرین های آن را بیاموزید:

پس در تست ها و پرسش هایی که بر اساس واکنش مس با نیتریک اسید است باید به غلظت اسید که در پرسش اشاره شده دقت کرد. اکنون دو تست از تست های سال های گذشته را حل می کنیم:
۱- از واکنش ۰/۱ اتم گرم مس با نیتریک اسید غلیظ، چند گرم گاز تولید می شود؟ (سراسری تجربی مرحله اول سال ۷۲)
گزینه ها:
۱) ۴/۶
۲) ۹/۲
۳) ۰/۰۴
۴) ۰/۰۵
داده های مسئله:
گرم مول ها
Cu=64
N=14
O=16
مسئله را به دو روش تناسب که سریع تر و آسان تر است و برای کنکور مناسب تر است و استوکیومتری که امروزه متداول شده است حل می کنیم:
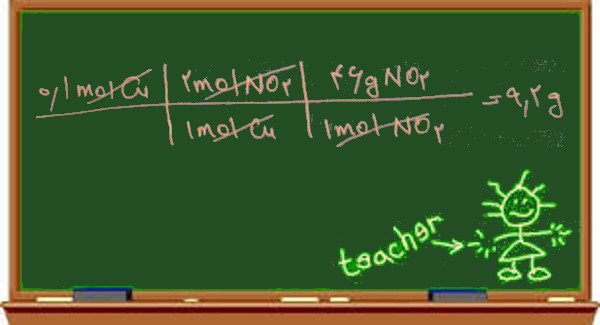
خوب یک بار دیگر به وا کنش مس با نیتریک اسید غلیظ نگاه کنیم:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
همان طور که می بینید در واکنش موازنه شده به ازای هر مول مس که در واکنش شرکت کرده دو مول گاز نیتروژن دی اکسید NO2 آزاد شده چون در صورت مسئله مقدار مس را بر اساس مول داده و مقدار NO2 را بر اساس گرم خواسته پس ما هم در تناسبی که تشکیل می دهیم مس را بر اساس مول و مقدار NO2 را بر اساس گرم می نویسیم پس در اینجا به جرم مولکولی NO2 نیاز داریم:
روش تناسب:
تست بعدی:
۲- در واکنش نیتریک اسید رقیق با مس به ازای مصرف ۱/۶ گرم مس، چند گرم گاز تشکیل می شود؟(سراسری تجربی مرحله اول سال ۷۳)
۱) ۰/۵
۲) ۰/۷۷
۳) ۱/۵
۴) ۱/۵۴
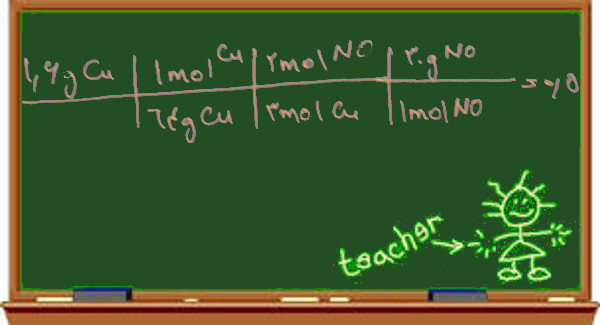
خوب بیایید دوباره به واکنش مس با نیتریک اسید رقیق نگاه کنیم:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
همان طور که می بینید به ازای هر سه مول مس، سه مول نیتروژن منو اکسید NO به دست می آید
چون هر دو مقدار مس و NO را بر اساس گرم داده و خواسته پس به جرم اتمی مس (۶۴) و جرم مولکولی NO (۱۴+۱۶=۳۰) نیاز داریم
روش تناسب:

روش استوکیومتری:






4 Comments
کاش مراحل موازنه رو قرار میداددید
درود
اپلیکیشن رایگان اکسایش کاهش را نصب کنید و بخوانید….آنجا آموزش داده ام
سلام عالی بود مرسی.
تشکر از مطلب خوبتون