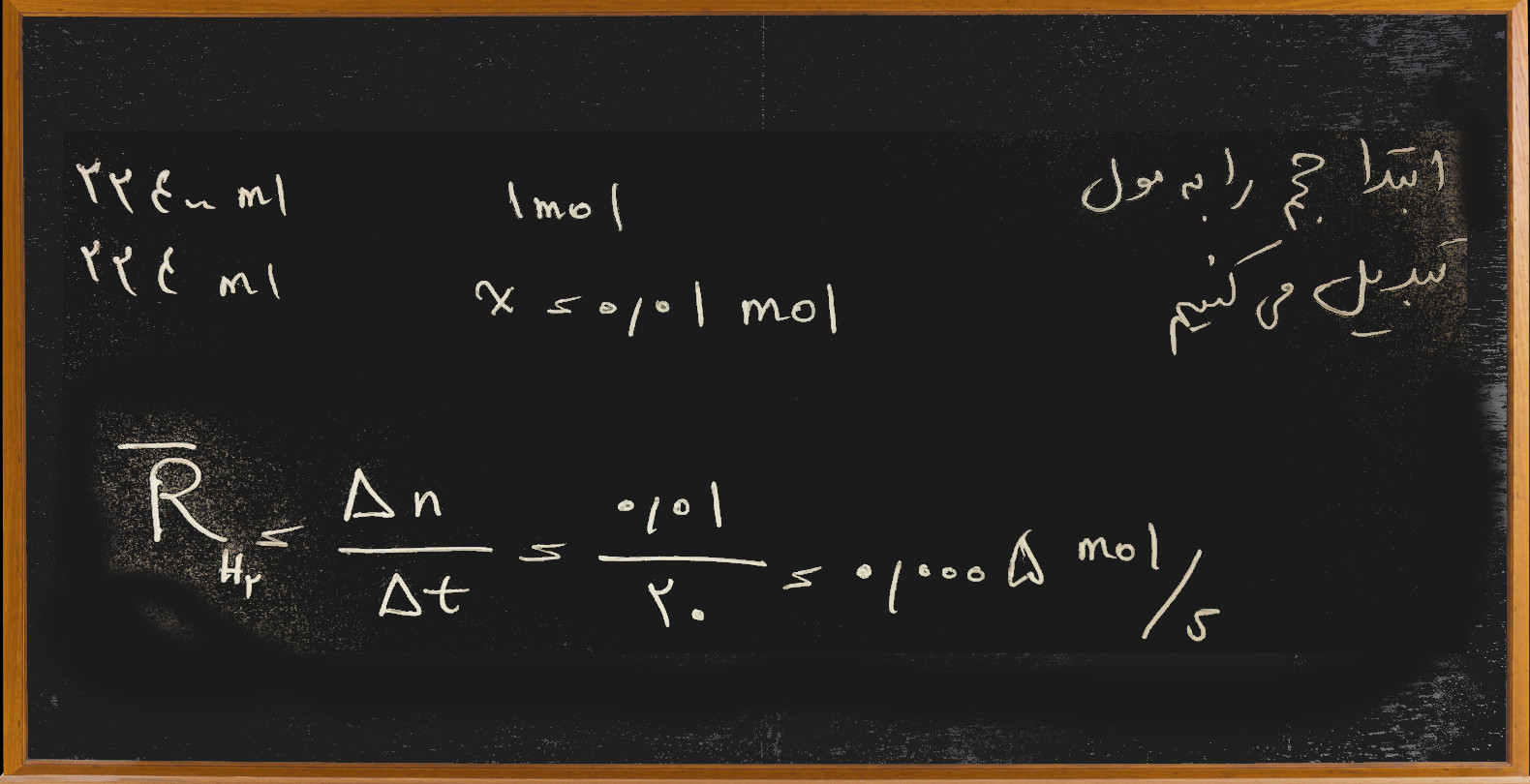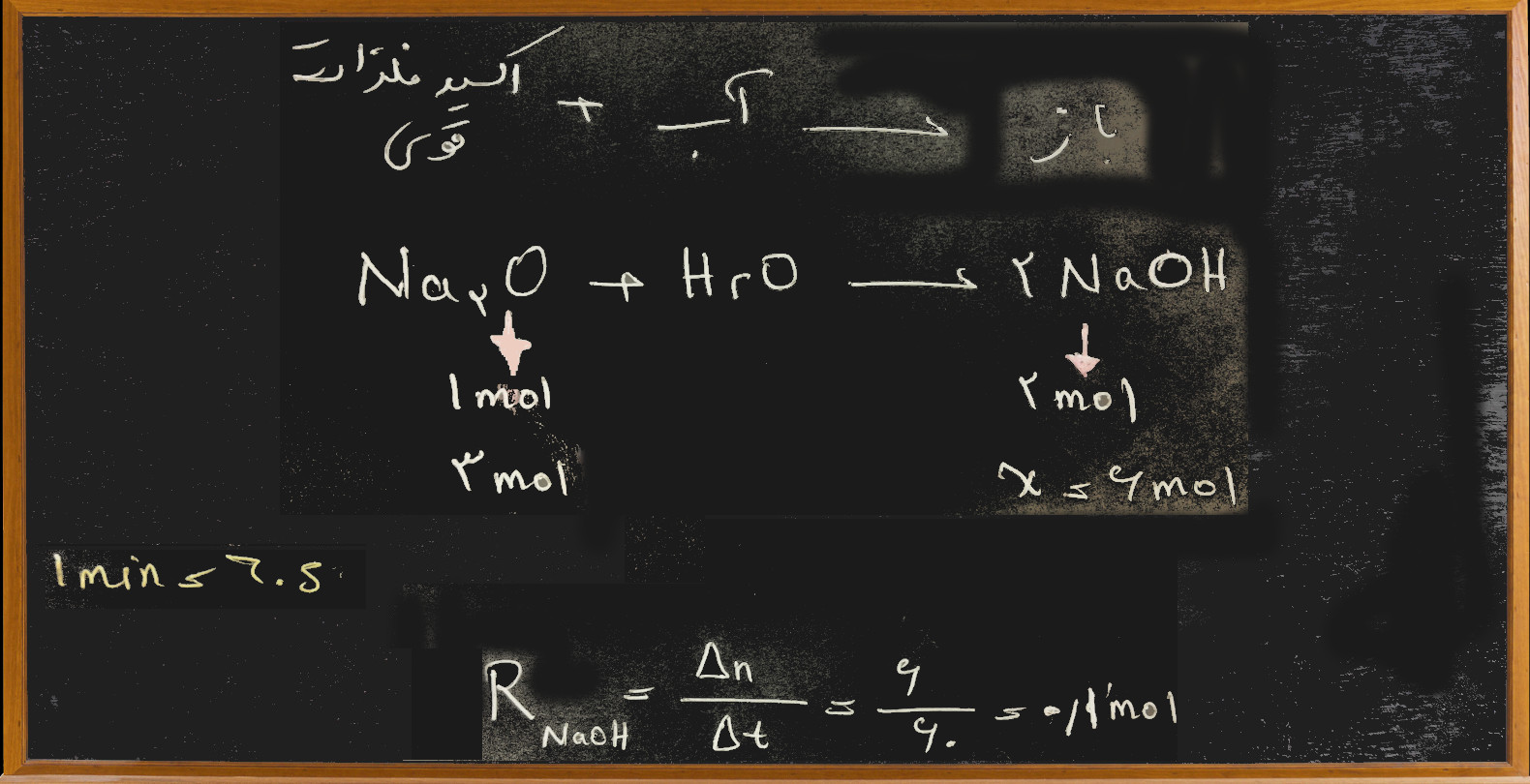نکات کنکوری شیمی (۷)

نکات کنکوری شیمی (۶)
مهر ۵, ۱۳۹۶
گرما در واکنش های شیمی
مهر ۷, ۱۳۹۶گاهی برای حل یک تست یا مسئله ی شیمی لازم است معادله واکنش موازنه شده برای آن نوشته شود و سپس بر اساس آن مسئله حل شود.
اما چه هنگام نیاز به نوشتن معادله واکنش داریم و چه هنگام بدون نوشتم معادله واکنش موازنه شده می توانیم تست یا مسئله را حل کنیم؟
اگر داده های مسئله بر اساس یک ماده و جواب بر اساس ماده ی دیگر باشد باید ابتدا معادله ی واکنش موازنه شده را بنویسیم و سپس آن را حل کنیم.
اما اگر داده ها بر اساس یک ماده و جواب خواسته شده هم بر اساس همان ماده باشد دیگر نیازی به نوشتن معادله واکنش نیست و نباید در کنکور برای آن وقت بگذاریم.
به دو مثال زیر توجه کنید:
۱) از واکنش فلز روی با هیدروکلریک اسید در یک سوم دقیقه، ۲۲۴ میلی لیتر گاز در شرایط متعارفی تولید می شود، سرعت متوسط تولید گاز بر حسب مول بر ثانیه کدام است؟
۱) ۰/۰۰۰۱
۲) ۰/۰۰۰۵
۳) ۰/۰۰۵
۴) ۰/۰۰۱
جواب: خوب همانطور که می بینید در تست بالا داده ها بر اساس گاز هیدروژن و جواب خواسته شده هم بر اساس همان گاز است پس در اینجا نیازی به نوشتن واکنش فلز روی با هیدروکلریک اسید نیست و به روش زیر تست حل می شود:
گزینه ی : ۲
اکنون به این تست نگاه کنید:
۲) اگر در واکنش سدیم اکسید با آب، در یک دقیقه ۳ مول از این اکسید مصرف شود، سرعت این واکنش از نظر تشکیل سدیم هیدرواکسید، چند مول بر ثانیه است؟
۱) ۰/۱
۲) ۰/۲
۳) ۰/۳
۴) ۰/۶
جواب: اما در اینجا داده ها بر اساس سدیم اکسید ولی جواب بر اساس سدیم هیدرواکسید خواسته شده پس باید معادله واکنش موازنه شده نوشته شود و بر اساس آن تست حل شود:
گزینه ی : ۱
برای فراگیری انواع واکنش های شیمیایی از اپلیکیشن رایگان “معادله واکنش بساز و موازنه کن” استفاده کنید.