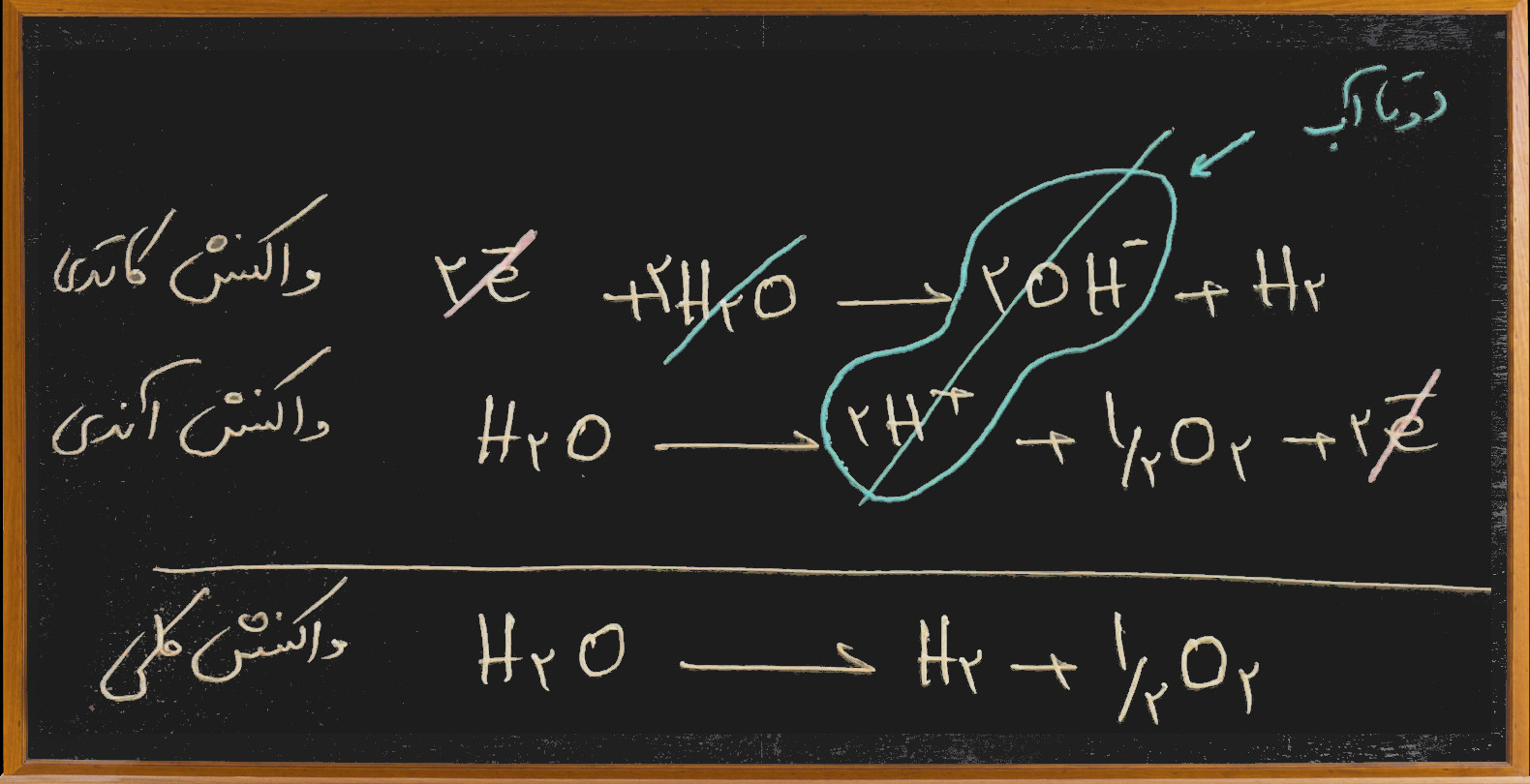نکات کنکوری شیمی ۱۸ (الکترولیز)

اثر نیتریک اسید بر فلزات
آبان ۳, ۱۳۹۶
تفاوت بین عناصر بلوک d و عناصر واسطه
آبان ۷, ۱۳۹۶- kian kiani
- kiandroid.ir
- kimical.ir
- آمادگی کنکور شیمی
- آموزش شیمی
- اپلیکیشن شیمی
- اپلیکیشن های شیمی
- اکسایش کاهش
- الکترولیز
- الکترولیز محلول سدیم سولفات
- بالاترین درجه اکسایش
- برقکافت
- تست شیمی
- تست کنکور سراسری
- تست های شیمی
- تقویتی شیمی
- تمرین های اضافی شیمی
- حا مسائل شیمی یازدهم
- حل تمرین های شیمی دهم
- حل تمرین های شیمی یازدهم
- حل مسائل شیمی دهم
- درس شیمی
- سایت شیمی
- سوالات کنکور شیمی
- شیمی
- شیمی دانشگاهی
- صنایع شیمی
- صنایع شیمیایی
- صنعت شیمی
- کنکور شیمی
- کیان دروید
- کیمیکال
- نکات کنکوری شیمی
- نکته های کنکوری شیمی
- نمونه تمرین های شیمی
- نمونه مسائل شیمی شیمی پیش دانشگاهی
- وب سایت شیمی
تست کنکور سراسری ریاضی سال ۷۴
ضمن عبور جریان برق از محلول سدیم سولفات، کدام تغییر زیر صورت می گیرد؟
۱- احیای یون سدیم در کاتد
۲- اکسایش یون سولفات در آند
۳- افزایش pH
۴- افزایش غلظت Na2SO4
نکته ی اول:
اگر محلول نمک های فلزات قلیایی یا قلیایی خاکی را الکترولیز کنیم به جای فلز قلیایی یا قلیایی خاکی، آب در کاتد کاهش می یابد و واکنش زیر اتفاق می افتد.
2e– + 2H2O → 2OH– + H2
دلیل: در سری الکتروشیمیایی پتانسیل کاهش فلزات قلیایی و قلیایی خاکی کوچکتر از هیدروژن است و در بالای هیدروژن قرار دارند. پس دوست ندارند الکترون بکیرند و کاهش بیابند این عناصر دوست دارند الکترون بدهند.
در سری الکترو شیمیایی عناصری که باالاتر هستند(پتانسیل کاهش کوچکتری دارند) دوست دارند الکترون بدهند( کاهنده هستند) و عناصری که در این سری پایین تر هستند دوست دارند الکترون بگیرند(اکسنده هستند)
پس تا اینجا معلوم می شود که گزینه ی ۱ که می گوید : احیای یون سدیم در کاتد، غلط است چون آب در کاتد کاهش می یابد.
نکته ی دوم:
اگر محلول نمک های فلئورید ، سولفات ، نیترات و یا هر عاملی که اتم مرکزی آن به بالاترین درجه ی اکسایش* خود رسیده باشد را الکترولیز کنیم به جای این عوامل آب در واکنش آندی اکسید می شود.
و واکنش آندی می شود:
H2O → 2e– + 2H+ + ½O2
دلیل: چون در این عوامل اتم مرکزی به بالاترین درجه اکسایش خود رسیده است پس دیگر نمی تواند الکترون از دست بدهد و اکسیژن آب با از دست دادن الکترون اکسید می شود.
تا اینجا معلوم شد گزینه ی ۲ هم غلط است.
گزینه ی ۳ هم غلط است چون در کاتد دو مول یون هیدرواکسید و کاتد را قلیایی (pH زیاد می شود) می کند و در آند هم دو مول هیدروژن می شود و آند را اسیدی (pH کم می شود) و اگر محلول را به هم بزنیم خنثی می شود.
اما گزینه ی آخر
اجازه بدهید ابتدا واکنش های کاتدی و آندی را با هم جمع کنیم ببینیم چه اتفاقی می افتد.
به تابلو سیاه توجه کنید:
همانطور که می بینید با جمع دو واکنش کاتدی و آندی در می یابیم در الکترولیز محلول سدیم سولفات فقط آب تجزیه می شود پس به مرور میزان آب کاهش می یابد و غلظت زیاد می شود.
* بالاترین درجه اکسایش برای یک عنصر برابر شماره ی گروه آن می باشد.
برای درک عمیق تر مفاهیم الکترولیز اپلیکیشن اکسایش کاهش را به کار ببرید.