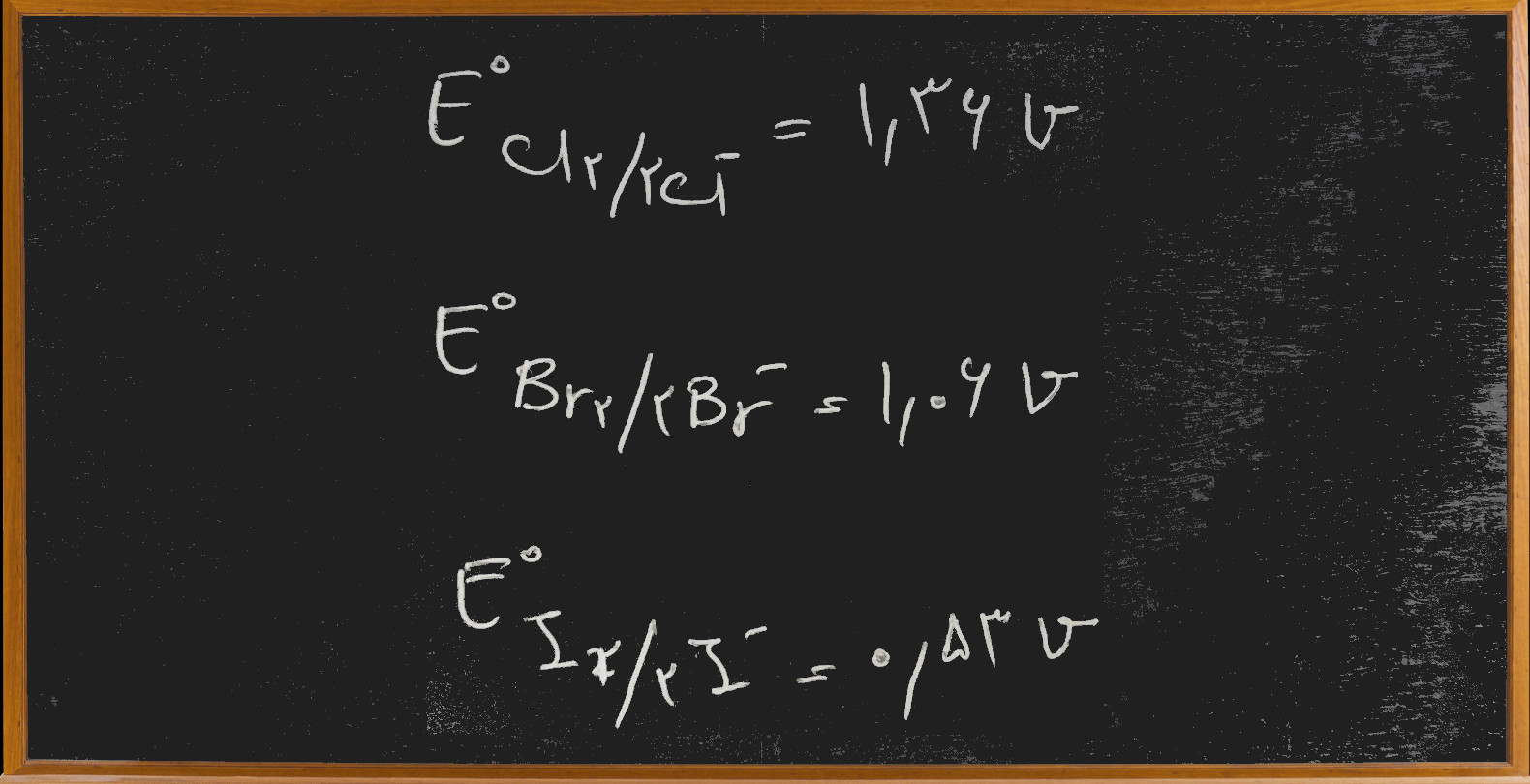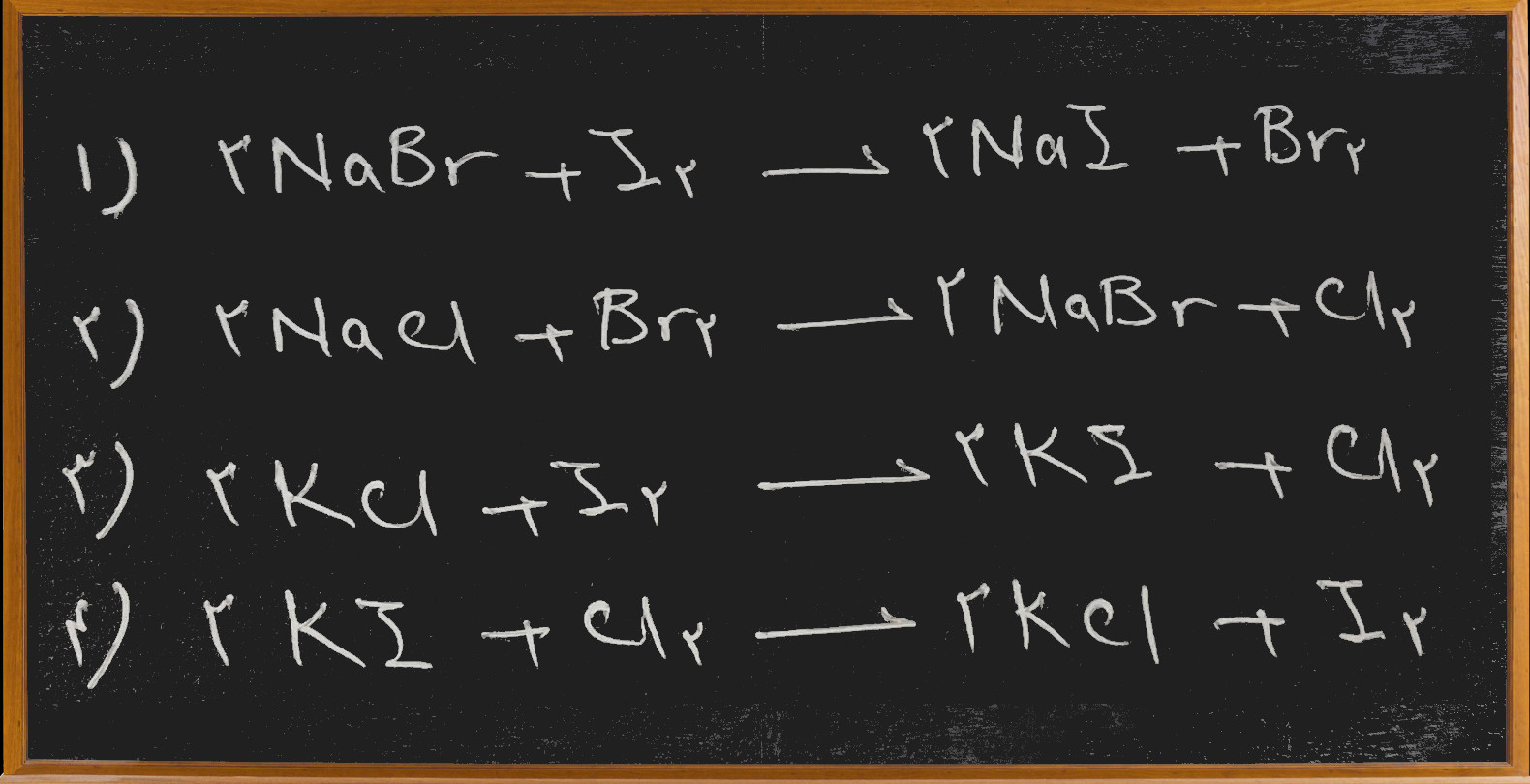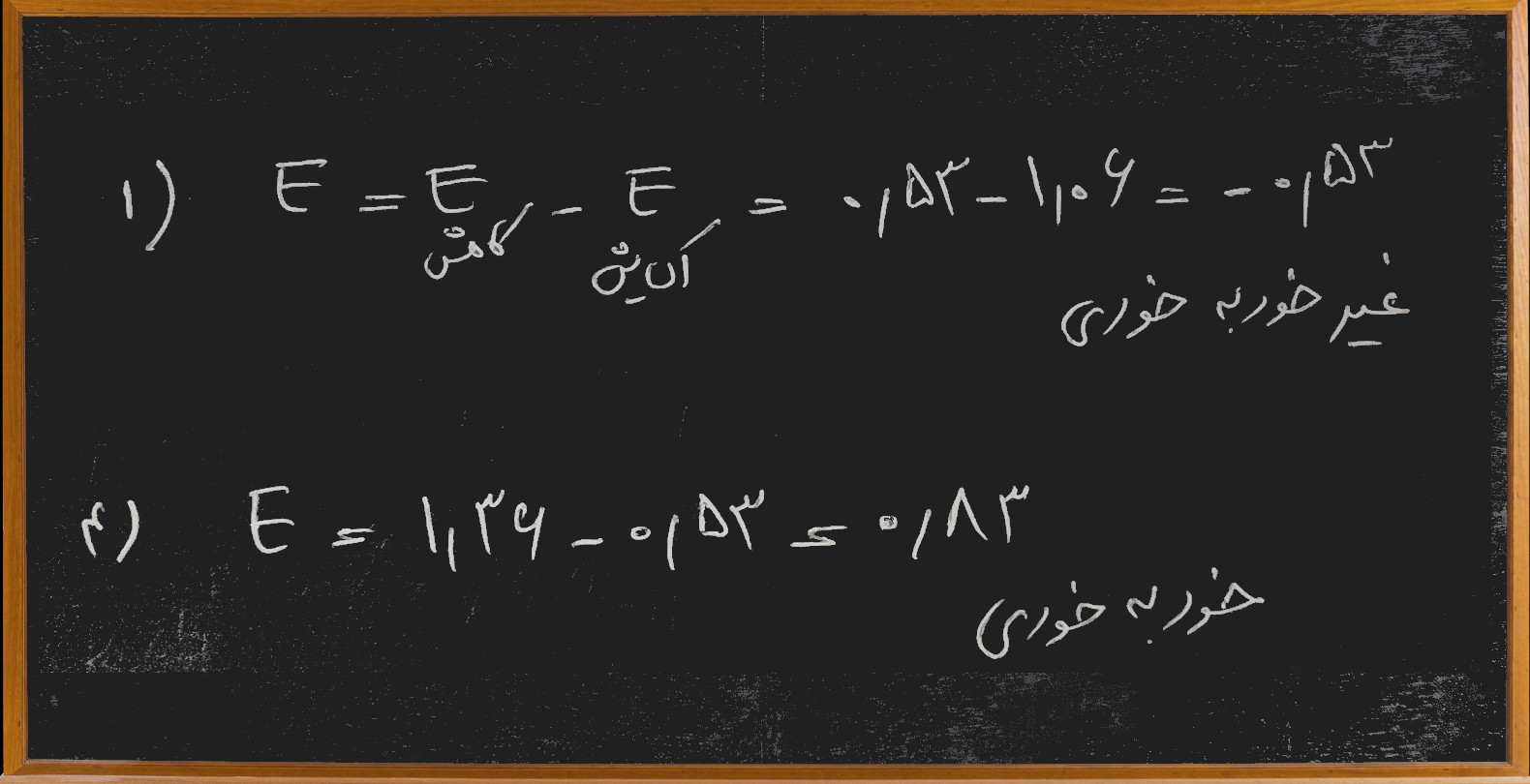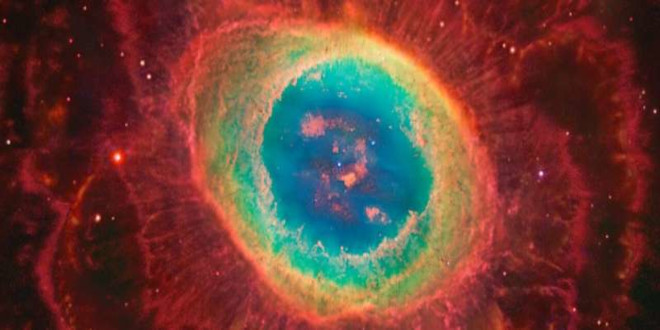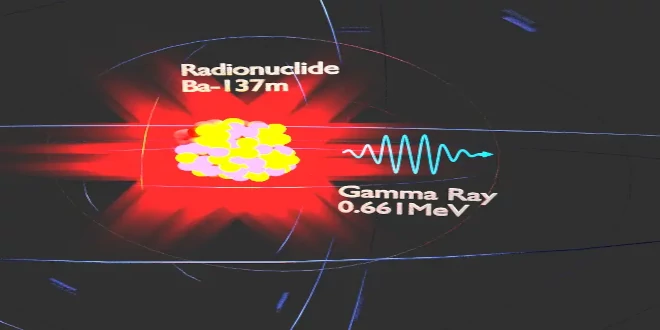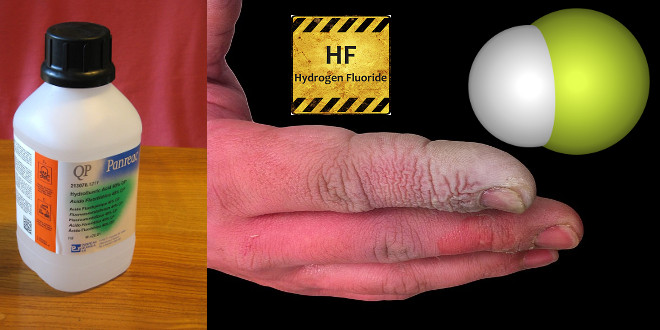
اثر هیدروفلئوریک اسید بر بدن
شهریور ۴, ۱۳۹۶
نکات کنکوری شیمی (۲)
شهریور ۲۸, ۱۳۹۶با توجه به داده های زیر کدام واکنش خود به خودی انجام پذیر است؟ (سراسری ریاضی سال ۶۵)
گزینه ها:
برای حل این تست دو راه پیش رو داریم یکی این که طبق روال معمول برای هر یک از واکنش ها نیرو محرکه را حساب کنیم، اگر نیرو محرکه مثبت باشد واکنش خود به خودی و اگر منفی باشد غیر خود به خودی است که ما برای گزینه های یک و چهار این محاسبه را انجام دادیم:
اما همان طور که می بینید کمی وقت گیر است اگر بخواهیم برای هر چهار گزینه این محاسبه را انجام بدهیم با توجه به این که گزینه ی چهارم درست است یعنی باید برای هر چهار واکنش محاسبه کنیم.
خوب آیا راه ساده تر و سریع تری نیست؟
چرا هست…
با توجه به این که همه ی این عناصر هالوژن هستند و در یک گروه جدول تناوبی (گروه هفتم اصلی) قرار دارند می توانیم از ویژگی الکترونگاتیوی که در شیمی عمومی آموخته ایم برای حل این تست استفاده کنیم بدون آن که قلم بر روی کاغذ ببریم و محاسبه ای انجام دهیم.
همان طور که می دانیم الکترونگاتیوی یعنی تمایل یک اتم برای گرفتن الکترون… از طرف دیگر می دانیم در جدول تناوبی، الکترونگاتیوی در یک گروه از بالا به پایین کم می شود (و در یک دوره از چپ به راست زیاد می شود) پس در گروه هالوژن ها عناصر بالاتر، الکترونگاتیو تر و می توانند از عنصر (یا یون) پایین تر از خود الکترون بگیرند ولی عکس آن به طور خود به خودی امکان پذیر نیست.
پس به این ترتیب در واکنش اول ید که در گروه هالوژن ها پایین تر از برم است از یون برم الکترون گرفته که چون الکترونگاتیوی ید کمتر از برم است خود به خود این واکنش امکان پذیر نیست.
در واکنش دوم برم (پایین تر) از کلر (بالاتر) الکترون گرفته و خود به خودی نیست.
در واکنش سوم هم همین طور ید(پایین تر) از کلر (بالاتر) الکترون گرفته و خود به خودی نیست.
ولی در واکنش چهارم کلر که بالاتر است و الکترونگاتیوی آن بیشتر است از ید که پایین تر و الکترونگاتیوی کمتری دارد الکترون گرفته که این به طور خود به خودی امکان پذیر است.
پس می بینید با دانستن این نکته، تستی را که در روش اول حدود یک دقیقه طول می کشد تا حل شود شاید در کمتر از ۱۵ ثانیه بتوانیم حل کنیم.
برای فراگیری عمیق تر این بخش از اپلیکیشن های اکسایش کاهش و از اتم تا استو کیومتری استفاده کنید.