چرا آنتالپی پیوند F-F از انتالپی پیوند Cl-Cl کمتر است؟

جزوه های آموزشی شیمی دهم
مرداد ۱۵, ۱۳۹۷
اینستاگرام به روز شد(راهنما)
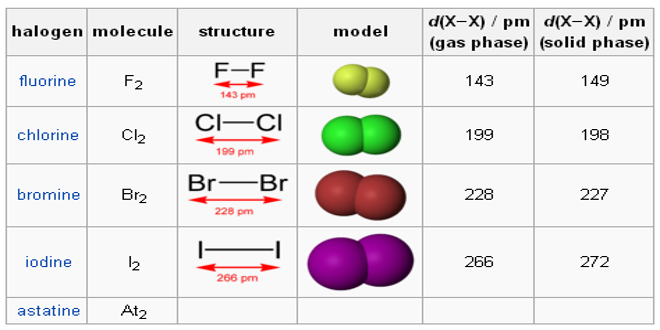
مرداد ۲۶, ۱۳۹۷چرا آنتالپی پیوند F-Fاز آنتالپی پیوند Cl-Cl کمتره؟با وجود اینکه شعاع اتمی فلوئور کمتره قاعدتا باید آنتالپی اش هم بیشتر باشه:
پاسخ از استاد علیرضا کیانی دوست:
در مولکول F2 شعاع اتمی بسیار کوچک است و غلظت ابر الکترونی در فضای میان هسته های دو اتم در گیر در پیوند بسیار زیاد و در نتیجه دافعه الکترونی افزایش یافته و باعث ناپایداری پیوند و سست شدن ان ( کاهش انرژی پیوند ) میشود . چون فلوئور در دوره دوم جدول و در قسمت انتهای اخر جدول است شعاع ان به شدت کاهش یافته و این دافعه بیشتر خود را نشان می دهد .
لازم به ذکر است که در این گروه طول پیوند مولکول I2 بسیار زیاد است و در نتیجه انرژی پیوند آن بسیار کم است پس کمترین را دارد و بعد از ان مولکول F2 به دلیل پدیده ای که گفتم انرژی پیوندش کمتر است بعد از ان برم و در نهایت کلر انرژی پیوند بیشتری دارد بنابراین ترتیب انرژی پیوند در مولکول های دو اتمی این گروه به صورت زیر است:
Cl2>Br2>F2>I2
همانطور که به دیاگرام اوربیتال مولکولی فلوئور را مشاهده می کنید پیوند بین دو اتم فئور از نوع سیگما است با همپوشانی سازنده سر به سر اوربیتال های p هر دو اتم ولی این اوربیتال مولکولی پیوندی فقط ناشی از دو الکترون از هر دو اتم فلوئور است که در فضای کوچک بین دو هسته قرار می گیرند مطلب بعدی بر می گردد به الکترون های ناپیوندی فلوئورها که تعداد بیشتری دارند و دافعه شدیدتری نیز اعمال میکندد هر چند که ازادی عمل بیشتری دارند . به طور کلی وقتی فاصله بین دو هسته بسیار کوتاه به همراه چگالی الکترونی زیادی باشد همپوشانی بخوبی صورت نمی گیرد و انرژی پیوند کاهش می یابد

البته همپوشانی اوربیتال های sبیشتر از همپوشانی اوربیتال های p باشد .یعنی فی نفسه این پیوند خودش کمی ضعیف است

واز تصاویر بالا پر واضح است که طول پیوندی p-p از همه بیشتر و قدرت آن کمتر است
حالا تصورش را بکنید خود پیوند کمی ضعیف است فضای اتمی فلوئور هم بسیار موچک است چقدر دافعه افزایش می یابد
نویسنده: علیرضا کیانی دوست





1 Comment
سلام خسته نباشید
در مقایسه ی انتالپی پیوند (در حد کنکور سراسری)،مرتبه پیوند مؤثر تر ا ز طول پیونده؟
مثلا اگه شعاع بیشتره باشه ولی مرتبه نسبت به یکی دیگه کمتر باشه؟