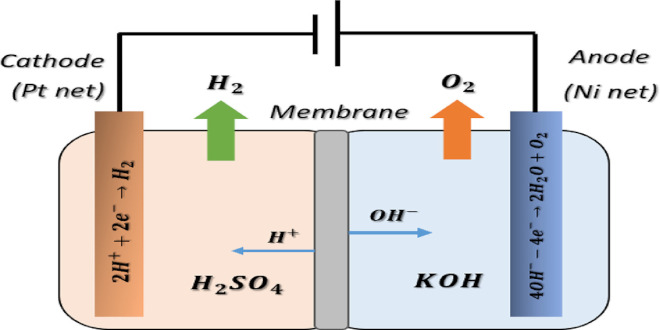
نکات الکترولیز

دو آزمایش بر روی آب چغندر
بهمن ۷, ۱۴۰۰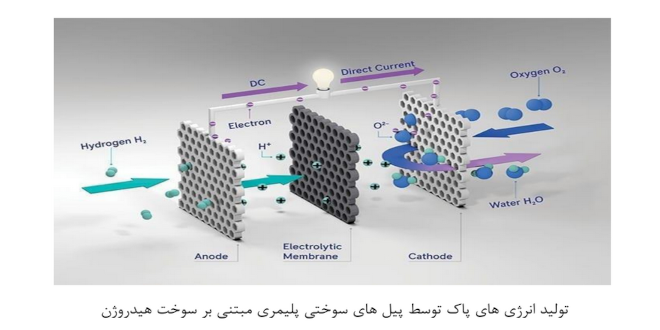
تولید انرژی های پاک توسط پیل های سوختی پلیمری مبتنی بر سوخت هیدروژن
بهمن ۱۹, ۱۴۰۰در الکترولیز:
-انرژی الکتریکی به انرژی شیمیایی تبدیل می شود.
– ولتاژ (نیرو محرکه یا نیروی الکتروموتوری) دستگاه الکترولیز همیشه منفی است.
– واکنش الکترولیز غیر خود به خودی است.
– الکترون ها توسط یک مولد وارد کاتد(قطب منفی) می شود.
– پس در قطب منفی (کاتد) عمل کاهش انجام می شود.
– الکترون ها از آند(قطب مثبت) خارج می شوند.
– پس در قطب مثبت (آند) عمل اکسایش انجام می شود.
– الکترولیت، نمک مذاب یا نمک یا اسید محلول است.
-در مورد نمک مذاب، کاتیون نمک در کاتد کاهش و آنیون آن در آند اکسایش می یابد.
– در مورد نمک محلول نیز همینطور بجز محلول نمک فلزات قلیایی و قلیایی خاکی که در آنها هیدروژن آب به جای کاتیون نمک کاهش مییابد و در کاتد گاز هیدروژن آزاد می شود.
-پس محلول نمک های فلزات قلیایی و قلیایی خاکی را وقتی الکترولیز می کنیم به جای فلزات قلیایی و قلیایی خاکی هیدروژن آب الکترون گرفته کاهش میابد
2H2O + 2e– → 2OH– + H2
– همچنین محلول نمک های نیترات، سولفات، فلئورید و هر آنیونی که اتم مرکزی آن به بالاترین درجه اکسایش خود رسیده باشد به جای آن آنیون ها ، اکسیژن آب اکسید میشود و در آند، گاز اکسیژن آزاد می شود.
2H2O → 4H+ + O2 + 4e–
نکته: در اثر الکترولیز محلول نمک هایی که کاتیون آن ها یکی از فلزات قلیایی یا قلیایی خاکی آنیون آن نیترات، سولفات یا فلئورید … باشد، فقط آب تجزیه می شود در نتیجه با الکترولیز چنین محلولی غلظت افزایش می یابد.
در مورد اسید هایی نظیر سولفوریک، نیتریک و فلئوریک اسید نیز همین طور و با الکترولیز محلول رقیق این اسید ها فقط آب تجزیه در نتیجه غلظت اسید افزایش و پی اچ کاهش می یابد.
همچنین هیدرواکسید های فلزات قلیایی و قلیایی خاکی که در الکترولیز محلول آنها نیز آب تجزیه شده و غلظت باز افزایش و در نتیجه پی اچ نیز افزایش می یابد.
محاسبه ماده آزاد شده در کاتد و آند:
برای محاسبه میزان ماده ای که در کاتد یا آند آزاد می شود، اگر مقادیر میزان الکتریسیته یا شدت جریان و زمان داده شده باشد از یکی از فرمول های زیر استفاده می شود.
که در فرمول های بالا: m جرم ماده آزاد شده در کاتد یا آند بر حسب گرم ،Q مقدار الکتریسیته بر حسب کولن، I شدت جریان بر حسب آمپر، t زمان بر حسب ثانیه، F ثابت فارادی برابر ۹۶۵۰۰ ، M جرم مولی ، n ظرفیت،E اکی والان می باشند.
اگر مقادیر کولن یا شدت جریان و زمان داده نشده باشد باید مقدار ماده آزاد شده در کاتد یا آند را از روش تناسب یا استوکیومتری بر اساس معادله واکنش کلی الکترولیز محاسبه کرد.
بیشتر بدانید:
کاربرد های الکترولیز:
الکترولیز یا برقکافت ، کاربردی از علم شیمی است که مبنای آن ، اکسایش کاهش و پتانسیل های اکسید و کاهش عناصر شیمیایی است و در آزمایشگاه و صنعت کاربردهای فراوانی دارد. با برخی از این کاربردها آشنا میشویم.
اندازه گیری جریان الکتریکی
الکترولیز ، روش مناسبی برای اندازه گیری باری است که از بخش معینی از مدار میگذرد. برای این منظور ، باید یک ظرف الکترولیتی را به این جزء مدارمتصل کرد (مانند بدست آوردن نقره) و جرم ماده رسوب کرده بر الکترودها را اندازه گرفت. از تقسیم جرم رسوب بر همارز الکتروشیمیایی آن ، مقدار باری که از این قسمت مدار گذشته است، بدست میآید.
برای تعیین جریان الکتریکی در مدار ، کافی است که جرم رسوب کرده روی الکترودها در زمانی را که طول کشیده است، اندازه بگیریم. اگر در این مدت زمان ، جریان تغییر نکرده باشد، نسبت جرم رسوب به زمان و همارز الکتروشیمیایی بر طبق قوانین الکترولیز فارادی جریان مدار را بدست میدهد.
مدرج کردن آمپرسنجها
با استفاده از مقادیر اندازه گیری شده برای همارزهای شیمیایی میتوان آمپرسنجها (گالوانومترها) با هر مبنای ساختمانی را با دقت بالایی مدرج کرد. برای این منظور کافی است ظرف الکترولیت و آمپرسنج را بطور متوالی به هم بسته و جریان ثابتی را درمدت زمان معین از آنها بگذرانیم (ثابت بودن جریان را میتوان از ثابت بودن عقربه به آمپرسنج کنترل کرد) و سپس بوسیله وزن کردن ، جرم جسم رسوب کرده را معین نماییم. اگر همارز الکتروشیمیایی ماده مربوط را بدانیم، میتوانیم مقدار الکتریسیته ای را که از مدار گذشته است، بر حسب کولن معین نماییم و از تقسیم مقدار بار بر زمان دایر بودن جریان (t) ، جریان بر حسب آمپر بدست میآید.
طبیعی است که این روش در عمل برای مدرج کردن آمپرسنج های استاندارد بکار میرود. اگر یک چنین آمپرسنج را بدقت مدرج کرده باشیم، با اتصال این آمپرسنج به هر سیستم آمپرسنجی بطور متوالی میتوانیم با آمپرسنج استاندارد ، آن را مدرج نماییم. با این روش ، دقت آمپرسنجها را نیز تست میکنند.
روش الکترولیتی بدست آوردن فلزات خالص
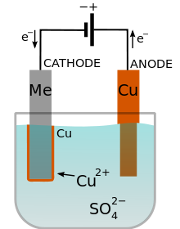
مس ، مثال گویایی از این خالص سازی یا تصفیه الکترولیتی است. سنگ معدن مس ، حاوی ترکیبی از مس با گوگرد ، اکسیدها و نیز ناخالصیهایی از فلزات بیگانه (Ni ، Pb ، Sb ، As ، Bi و غیره) است. مسی را که مستقیما از سنگ معدن بدست آمده و دارای ناخالصیهایی است، به شکل تیغههایی قالبریزی و بهعنوان آند در محلول سولفات مس قرار میدهند.
با انتخاب ولتاژ مناسب (۰/۲v تا ۰/۲۵ ولت) در الکترودهای الکترولیت میتوان اطمینان یافت که فقط فلز مس در کاتد رسوب میکند. ناخالصیهای بیگانه یا به داخل محلول میروند (بدون رسوب در کاتد) یا در کف قرار میگیرند و فلز خالص مس در کاتد ایجاد میگردد.
آبکاری الکتریکی
با استفاده از الکترولیز ، فلزی را میتوان با لایه ای از فلزات دیگر پوشانید (لایه نشانی). این فرایند به آبکاری الکتریکی معروف است. از نظر فنی ، مهم ترین کاربرد آبکاری با فلزات خاصیت اکسایش ضعیف است ( بخصوص ، آبکاری نیکل و کرم). همین طور ، آبکاری نقره و طلا برای محافظت فلزات از خوردگی در هوا است.
برای بدست آوردن پوشش لازم ، جسم را بطور مکانیکی ، کاملا تمیز و چربیزدایی میکنند و آن را بهعنوان کاتد در محلول الکترولیتی حاوی نمک فلزی قرار میدهند که جسم باید با آن آبکاری شود. برای اینکه آبکاری یکنواختتر باشد، بهتر است دو تیغه بهعنوان آند بکار گرفته شود و جسم بین آن دو قرار گیرد.
قالبسازی الکتریکی ، نمونه ای از کاربردهای ویژه الکترولیز در صنعت میباشد. با استفاده از الکترولیز نه فقط میتوان اشیا را با لایه ای از فلزات پوشش داد، بلکه میتوان نمونههای فلزی برجسته ای از آنها تهیه کرد (مثل سکهها ، مدالها و غیره). این فرایند را در سال های ۱۸۴۰ ، “یاکوبی” (B.S.Yakobi) فیزیک دان و مهندس برق روسی تکامل بخشید و آن را شکلسازی الکتریکی نام نهاد.
برای ساختن یک نمونه برجسته از یک شیء ابتدا قالب شیء با ماده پلاستیکی مثل موم ساخته میشود. این قالب با پوشش خود بوسیله گرافیت ، رسانای الکتریسیته میشود و سپس بهعنوان کاتد در محلول الکترولیت کار گذاشته میشود. در خلال الکترولیز ، لایه ای از فلز با ضخامت مورد نظر بر قالب مینشیند.
قالبسازی الکتریکی ، کاربرد مهمی در چاپ ، یعنی چاپ الکتریکی دارد. در این فرایند ، یک متن از پیش نوشته معمولی تهیه میشود. سپس قالبی از موم یا پلاستیک برای آن ساخته میشود. پس از پوشش قالب با گرافیت ، آن را در محلول الکترولیت قرار میدهند و در آنجا لایه کلفتی از مس روی آن مینشیند. برای استحکام این لایه ، پشت نمونه را با فلز چاپ آلیاژی با نقطه ذوب پایین با ماده اولیه سرب) پوشانده میشود. نمونه بدست آمده از پیش نوشته بعدا برای چاپ بکار میرود.


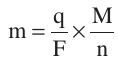
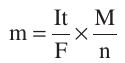
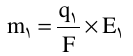



4 Comments
درود استاد
در مورد موضوع خالص کردن مس ؛ ولتاژ لازم برای جدا کردن فلزات مختلف از همدیگه رو چجوری بدست میارن ؟
مثلا جداکردن یک فلز خاص از میان بقیه فلزات در یک محلول اسیدی حاوی چند اسید مختلف
درود استاد
در مورد موضوع خالص کردن مس ؛ اول اینکه ولتاژ لازم برای جدا کردن فلزات مختلف از همدیگه رو چجوری بدست میارن ؟
مثلا جداکردن یک فلز خاص از میان بقیه فلزات در یک محلول اسیدی حاوی چند اسید مختلف
و اینکه آیا در این حالت کنترل جریان هم تاثیری دارد ؟
درود بر شما
از طری الکترود استاندارد
بله کنترل جریان ار دارد
ممنون