طبقه بندی تناوبی عناصر
شیمی آلی چیست؟
آذر ۱۳, ۱۳۹۳در بررسی ترتیب عناصر مشاهده می شود که یک تکرار دوره ای از نظر تعداد الکترون لایه ی آخر وجود دارد. برای مثال فلوئور، کلر ، برم و ید، همه ی این عناصر در لایه ی آخرشان هفت الکترون دارند. عناصری که لایه ی آخرشان تعداد الکترون یکسان دارند دارای خواص شیمیایی (و حتی تا حدودی فیزیکی) یکسانی هستند زیرا این الکترون های لایه ی آخر هستند که در واکنش های شیمیایی شرکت می کنند.
ساختار جدول تناوبی
اگر عناصر را در یک جدول به ترتیب عدد اتمی مرتب کنیم به گونه ای که عناصری که تعداد الکترون یکسانی در لایه ی آخرشان دارند(که در نتیجه خواص یکسانی دارند) زیر هم در یک ستون قرار بگیرند نتیجه شکلی میشود که به آن جدول تناوبی می گویند. به این جدول
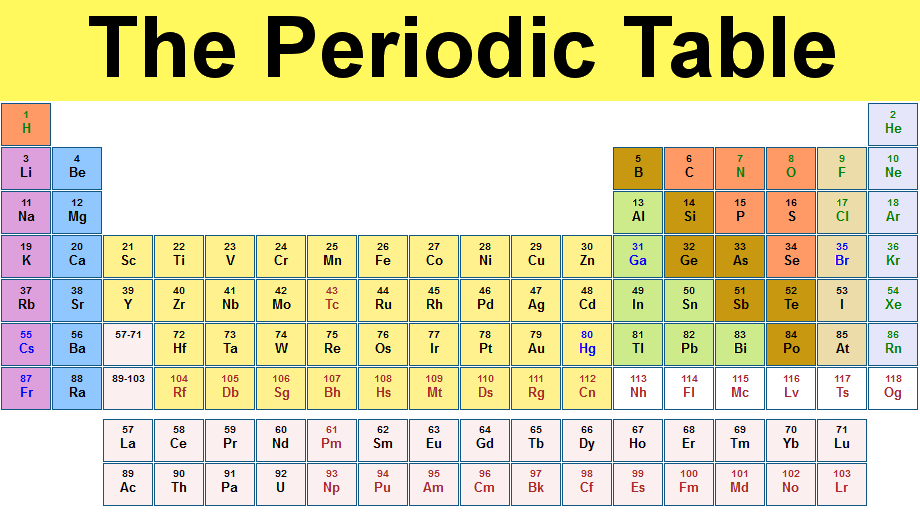
، طبقه بندی تناوبی عناصر نیز می گویند.
ستون های عمودی، گروه، و ردیف های افقی، تناوب یا دوره نامیده می شوند.هر تناوب با یک فلز قلیایی شروع (هیدروژن در اولین تناوب یک استثناء است) وبه یک گاز نجیب ختم می شود.
در سه تناوب اول (دوره های کوتاه) الکترون ها فقط به لایه ی آخر افزوده می شوند و وقتی از عنصری به عنصر دیگر می رویم تفاوت ناچیزی در خواص مشاهده میشود. برای مثال در دوره سوم جدول تناوبی از چپ به راست:
سدیم Na، فلزی خیلی نرم و بسیار واکنش پذیر
منیزیم Mg، فلزی ترد و شکننده و فعال
آلومینیم Al، فلزی نرم که برخی خواص نافلزی دارد
سیلیسیم Si، نا فلزی با فعالیت شیمیایی ناچیز
فسفر P، نا فلزی تقریبا” فعال
گوگرد S، نا فلز خیلی فعال
کلر Cl، نا فلز، گازی با فعالیت شیمیایی بسیار بالا
آرگون Ar، نا فلز، گاز نجیب
در سه تناوب بعدی (دوره های بلند) الکترون ها فقط در دو عنصر اول وهمچنین در شش عنصر آخر به لایه ی آخر افزوده میشوند. عناصر میانی با پر شدن لایه های درونی از الکترون ساخته میشوند در حالی که تعداد دو الکترون در لایه ی آخر ثابت است( بجز چند استثناء ، مثل مس) برای مثال تناوب چهارم را ببینید:
پتاسیم K، فلزی خیلی نرم و بسیار واکنش پذیر
کلسیم Ca، فلزی ترد، شکننده و فعال
عناصر واسطه Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn اکثرآ محکم ، فلزاتی تقریبا” فعال که از خود چندین ظرفیت نشان می دهد و یون های آب دار آن ها رنگی هستند همچنین آلیاژ تشکیل می دهند.
گالیم Ga، فلزی نرم که برخی خواص نافلزی دارد
ژرمانیم Ge، شبه فلز
ارسنیک As، نا فلزی تقریبآ فعال
سلنیم Se، نا فلزی تقریبآ فعال
برم Br، نا فلز، مایعی با فعالیت شیمیایی بسیار بالا
کریپتون Kr، نا فلز، گاز نجیب
عناصر میانی (که همه در وسط جدول تناوبی قرار دارند) عناصر واسطه نامیده می شوند. که در بخش فلزات واسطه بررسی می کنیم فقط به این نکته اشاره می کنیم که تغییر در هر دوره، زمانی که از عناصر واسطه عبور می کنیم چشم گیر است.
انواع عناصر:
جدول شکل زیر نشان می دهد که چگونه عناصر به چهار گروه طبقه بندی می شوند
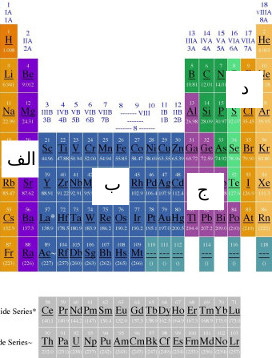
الف- فلزات الکتروپوزتیو قوی
ب- عناصر واسطه (فلزات واسطه)
ج- فلزات الکتروپوزتیو ضعیف و شبه فلزات
د- نافلزات
مقایسه ی فعالیت شیمیایی و نوع پیوند:
-تشکیل یون و فعالیت شدید بستگی به عوامل زیر دارد :
۱) باافزایش شعاع اتمی یون های مثبت راحت تر تشکیل می شوند. (الکترون ها بیشتر آماده اند تا از اتم جدا شوند)
۲) با کاهش شعاع اتمی یون های منفی راحت تر تشکیل می شوند. (الکترون ها آمادگی بیشتری برای جفت شدن دارند)
۳) تعداد الکترون های کم لایه ی ظرفیت (۱ یا ۲ و یا ۳) باعث می شود تا اتم الکترون از دست بدهد تا به آرایش گاز نجیب برسد ولی اگر الکترون های لایه ی ظرفیت بین ۴ تا ۸ الکترون باشد تمایل به گرفتن الکترون دارد.




7 Comments
to in google b in bozorgi mn y thqiq vase tbqebndie anasor ntostm peida konm
باید زبان انگلیسیتون را خوب کنید
همچنین اپلیکیشن شیمی معدنی را بخوانید لطفآ
خودت میدونی چی نوشتی؟
دوباره بخونید
حتما مشکل از گوگل بوده.
سلام. خوب بود ولی عالی نبود.
عالی نبود ولی خیلی کمک کرد.
درود بر شما
برای مطالعه کامل تر اپلیکیشن شیمی معدنی را بخوانید