سرعت واکنش های شیمیایی

گرما در واکنش های شیمی
مهر ۷, ۱۳۹۶
تعادل های شیمیایی ۱
مهر ۱۱, ۱۳۹۶سرعت واکنش های شیمیایی یکسان نیست، برخی واکنش ها خیلی تند (مثل انفجار) و برخی بسیار کند(مانند زنگ زدن) می باشد.
مدت زمانی که طول می کشد مول های مواد اولیه به فراورده ها تبدیل شود را سرعت واکنش می گویند.
-شرایط لازم برای انجام یک واکنش
۱)تعداد برخوردها
۲) راستای مناسب
۳) انرژی لازم
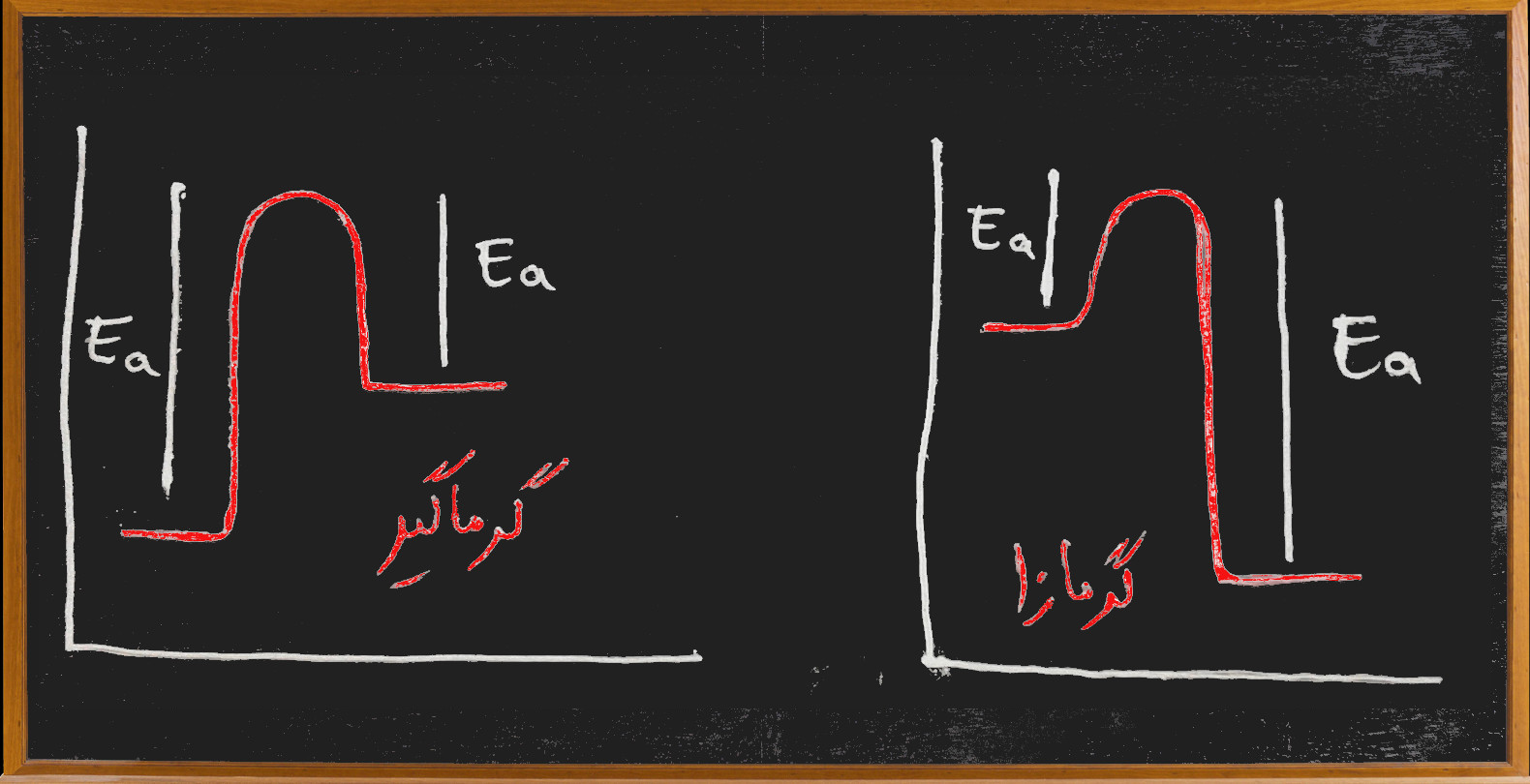
-تعریف انرژی فعالسازی Ea: حداقل انرژی لازم برای انجام یک واکنش
– تعریف کمپلکس فعال: ماده ی حد واسط بین مواد اولیه و فراورده ها می باشد که ناپایدار بوده به سرعت به فراورده ها تبدیل می شود
-تعیین گرمای واکنش با انرژی فعال سازی
ΔH=Ea(رفت) -Ea(برگشت)
-انرژی فعال سازی و سرعت واکنش: انرژی فعال سازی برای واکنش ها مانند سربالایی برای اتوموبیل هاست هر چه انرژی فعال سازی بیشتر ، سرعت واکنش کمتر
-عوامل موثر در سرعت واکنش:
دما: با افزایش دما جنبش مولکول ها بیشتر، تعداد برخوردها بیشتر و در نتیجه سرعت واکنش بیشتر می شود.
غلظت: با افزایش غلظت تعداد برخوردها بیشتر، در نتیجه سرعت واکنش بیشتر می شود.
کاتالیزگر: کاتالیزگر با کمتر (یا بیشتر) کردن انرژی فعال سازی سرعت واکنش را تغییر می دهد.
برای فراگیری بهتر پیش نیازهای این بخش از شیمی عمومی اپلیکیشن از اتم تا استوکیومتری را مطالعه کنید
همچنین دیگر اپلیکیشن های شیمی مارکت کیان دروید را اینجا ببینید:







2 Comments
ممنون از تدریس خوبتون سماس از تون استاد محترم معلم گرامی اقای کیان کیانی ممنون
ممنون از تون سپاس ??استاد گرامی از این مطالب مهم استاد کیان کیانی موفق با شید