
تاریخچه کشف امواج فرابنفش
مهر 18, 1403
کتاب طیف نگاری و اختر شیمی
آبان 25, 1403آرایش الکترونی عناصر چه اطلاعاتی درباره یک عنصر به ما می دهند؟
در این پست قصد نداریم آرایش الکترونی را آموزش دهیم بلکه می خواهیم کاربردهای آرایش الکترونی را بیان کنیم اما اگر آرایش الکترونی را تا کنون نیاموخته اید ابتدا اپلیکیشن رایگان اندرویدی از اتم تا استوکیومتری را دانلود و نصب کنید و در بخش نکات بخش نکات اتم ۱ و همچنین بخش نکات اتم ۲ را بیاموزید سپس این پست را بخوانید.
برای این که در نوشتن آرایش الکترونی یک عنصر مهارت پیدا کنید بهترین کار این است که در ابتدا جدول تناوبی پیش روی شما باشد و بر اساس آن آرایش الکترونی را بنویسیم در این صورت نه تنها آرایش الکترونی را تمرین میکنید جدول تناوبی هم برای شما هر بار مرور می شود که این بسیار مهم است.
یک بار دیگر به جدول تناوبی نگاه کنید:
دو ردیف پایین لانتانیدها و اکتنیدها هستند که برای آن که جدول تناوبی جمع و جور تر شود این دو دوره را برش داده و پایین قرار داده اند. پس در حقیقت جدول تناوبی به شکل زیر است:
 اکنون که با ساختار واقعی جدول تناوبی آشنا شدیم به این سوال بر می گردیم که آرایش الکترونی چه اطلاعاتی درباره عناصر به ما می دهد.
اکنون که با ساختار واقعی جدول تناوبی آشنا شدیم به این سوال بر می گردیم که آرایش الکترونی چه اطلاعاتی درباره عناصر به ما می دهد.
همان طور که می دانیم به دو صورت می توانیم آرایش الکترونی را نمایش دهیم.
۱- نمایش لایه های اصلی
۲- نمایش زیر لایه ها شامل اربیتال های s و p و d و f
شکل زیر لایه های اصلی و زیر لایه های آن ها را نشان می دهد:
نمایش لایه های اصلی بیشتر برای مبتدی ها استفاده می شود اما با این وجود اطلاعاتی در اختیار ما می گذارد
به آرایش الکترونی عنصر پتاسیم با عدد اتمی ۱۹ نگاه کنید.
اطلاعاتی که آرایش الکترونی بالا در اختیار ما می گذارد شامل:
۱- دوره( در جدول تناوبی عناصری که از چب به راست مرتب شده اند دوره یا تناوب نامیده می شود): تعداد لایه ها نشان دهنده دوره است بنابر این پتاسیم در دوره چهارم جدول تناوبی قرار دارد.
۲-گروه(در جدول تناوبی عناصری که از بالا به پایین مرتب شده اند گروه نامیده می شوند): تعداد الکترون های لایه آخر شماره گروه است. پس پتاسیم در گروه اول جدول تناوبی(فلزات قلیایی) قرار دارد. تا اینجا فلز پتاسیم را در گروه اول و دوره چهارم در جدول بالا پیدا کنید.
۳- فلز یا نافلز بودن: در عناصر اصلی(دو گروه اول و شش گروه آخر) اگر لا یه آخر ۱ تا ۳ الکترون داشته باشد فلز و اگر ۴-۸ الکترون داشته باشد نافلز می باشد در این صورت چون در لایه آخر پتاسیم یک الکترون وجود دارد فلز می باشد.
۴-ظرفیت(تعداد الکترون هایی که یک فلز از دست می دهد یا یک نافلز می گیرد تا به آرایش الکترونی گاز نجیب نزدیک خود برسد): چون فلز پتاسیم با از دست دادن یک الکترون لایه آخر خود را از دست داده و به آرایش گاز نجیب نزدیک خود Ar می رسد پس ظرفیت آن ۱ می باشد. یا هالوژن ها(گروه هفتم اصلی یا هفدهم) چون در لایه آخر هفت الکترون دارند با گرفتن یک الکترون باز به آرایش گاز نجیب می رسند و ظرفیت آن ها هم ۱ است.
آرایش الکترونی گازهای نجیب:
ظرفیت:
گروه های اصلی جدول تناوبی
با توجه به گروها های اصلی جدول تناوبی ظرفیت به شکل زیر می شود.
| گروه اصلی | ۱ | ۲ | ۳ | ۴ | ۵ | ۶ | ۷ | ۸ |
| ظرفیت | ۱ | ۲ | ۳ | ۴ | ۳ | ۲ | ۱ | ۰ |
چهار مورد از اطلاعاتی که از آرایش الکترونی لایه های اصلی به دست می آید را بررسی کردیم. اکنون ببینیم نوشتن آرایش الکترونی عناصر با استفاده از زیرلایه های (s,p,d,f) چه اطلاعات ارزشمندی به ما می دهند؟
۵- بلوک جدول تناوبی: نوشتن آرایش الکترونی با استفاده از زیر لایه ها نشان می دهد آن عنصر به کدام بلوک (s,p,d,f) جدول تناوبی تعلق دارد. برای این منظور پس از نوشتن آرایش الکترونی نگاه می کنیم کدام زیر لایه در پایان کاملآ پر شده یا نیمه پر مانده است.
 در مثال بالا عناصر به ترتیب در بلوک های (s) و (p) و (d) و (f) قرار دارند.
در مثال بالا عناصر به ترتیب در بلوک های (s) و (p) و (d) و (f) قرار دارند.
۶- رنگ ترکیبات: از آنجایی که عناصر ترکیبات واسطه و لانتانیدها و اکتنیدها اغلب رنگی هستند بنابر این اگر پس از نوشتن آرایش الکترونی معلوم شد آن عنصر در بلوک های d یا f قرار دارند(مانند مثال های ۳ و ۴ ) انتضار داریم که احتمالآ ترکیبات آن ها رنگی باشند.
۷- حالت های برانگیختگی: (حالت بر انگیختگی حالتی است که در صورت وجود اوربیتال های بعدی الکترون ها در اثر تهییج به آن اربیتال ها منتقل می شوند در نتیجه تعداد اوربیتال های تک الکترونی بیشتر می شوند):
یکی دیگر از اطلاعاتی که از آرایش الکترونی به دست می آوریم وجود حالت های بر انگیختگی و تشخیص ترکیباتی که می توانند یا نمی توانند وجود داشته باشند.
به مثال زیر که دو عنصر نیتروژن و فسفر را که هر دو در گروه پنجم اصلی یا در گروه پانزدهم هستند از این نظر مقایسه کرده ایم:
تمرین: دو عنصر فلئور و کلر که هر دو در گروه هفتم اصلی هستند از نظر آرایش الکترونی مقایسه کنید و نشان دهین فلئور حالت بر انگیخته ندارد و همچنین نشان دهید کلر چند حالت بر انگیخته و در نتیجه چند ظرفیت می تواند داشته باشد؟
۸- حالت برانگیختگی و اعداد اکسایش یک عنصر: از طریق حالت های برانگیختگی یک عنصر می توان به اعداد اکسایش آن عنصر پی برد.
عدد اکسایش باری است قرار دادی که به یک عنصر در یک ترکیب تعلق می گیرد به این ترتیب که عنصر الکترونگاتیوتر بار منفی و عنصر الکتروپوزتیوتر بار مثبت پیدا می کنند. برای آموزش قواعد تعیین اعداد اکسایش عناصر در یک ترکیب اپلیکیشن رایگان اکسایش کاهش را بخوانید.
برای مثال حالت های اصلی و برانگیخته آرایش الکترونی عنصر کلر و درجات اکسایش مختلف آن را ببینید:
در این مقاله به طور جداگانه ظرفیت و عدد اکسایش را تعریف کردیم. برای این که تفاوت این دو را بهتر یاد بگیرید به ظرفیت و عدد اکسایش کربن در ترکیبات زیر دقت کنید:
۹- تشخیص نوع پیوند از نظر یونی یا کووالانسی: (با پیوند یونی و کوالانسی آشنایی ندارید؟ پس ابتدا داستان پیوند یونی و داستان پیوند کووالانسی را بخوانید)
همه ی عناصر گروه های s و d و f و تقریبآ نیمی از عناصر بلوک p فلزات هستند بنابر این پیوند یونی تشکیل می دهند و تقریبآ نیمی از عناصر بلوک p نافلزات هستند و با فلزات نمک ها(یونی) و با یکدیگر ترکیبات کووالانسی را تشکیل می دهند.
۱۰- تشخیص تعداد پیوند داتیو از روی آرایش الکترونی:(با پیوند داتیو آشنایی ندارید؟ پس ابتدا داستان پیوند داتیو را بخوانید)
اگر پس از نوشتن آرایش الکترونی در لایه ظرفیت اربیتال های پر وجود داشته باشد، به تعداد اربیتال های پر پیوند داتیو وجود دارد. به نیتروژن و فسفر در مثال بالا نگاه کنید، هر دو یک اربیتال پر دارند بنا بر این هر کدام یک پیوند داتیو می توانند تشکیل بدهند.
در شکل زیر تعداد پیوندهای داتیو در نیتریک اسید، فسفریک اسید و پر کلریک اسید با فلش نمایش داده شده است:
تعداد پیوندهای داتیو کلر را از تمرین قبل ببینید.
همچنین عناصر و یا یون هایی که اوربیتال خالی دارند می توانند پیوند داتیو بپذیرند مانند یون کوپریک که با چهار مولکول آب به صورت داتیو پیوند برقرار می کند(آب تبلور):
۱۱- تشخیص خاصیت مغناطیسی مواد:
اگر در آرایش الکرونی یک عنصر و یا یون همه الکترون ها جفت شده باشند آن عنصر یا یون دیامغناطیس است یعنی میدان مغناطیسی را دفع می کند یا از آن فرار می کند.
اگر در آرایش الکرونی یک عنصر و یا یون اربیتال های تک الکترونی جفت نشده وجود داشته باشد آن عنصر یا یون پارا مغناطیس است یعنی میدان مغناطیسی را جذب می کند.(خاصیت مغناطیسی ضعیف و موقتی)
در مورد پارا و دیا مغناطیس این فیلم در یوتیوب مفید است.
۱۲- کاربرد آرایش الکترونی در طیف نگاری: آرایش الکترونی عناصر مستقیمآ بر روی ویژگیهای طیفی اتم ها و مولکول ها تاثیر می گذارد و از طیف نگاری ابزاری برای مطالعه ساختار الکترونی و رفتار آن ها می سازد
۱۳- هیبریداسیون: از طریق آرایش الکترونی به نوع هیبریداسیون اتم مرکزی در یک ترکیب کووالانسی و شکل فضایی مولکول پی می بریم. آموزش هیبریداسیون به طور کامل در اپلیکیشن از اتم تا استوکیومتری بخش نکات، بخش نکات ساختار لوویس موجود است.
۱۴- اعداد کوانتومی: یکی دیگر از اطلاعاتی که آرایش الکترونی به ما می دهد اعداد کوانتومی است برای مطالعه اعداد کوانتومی باز هم به اپلیکیشن از اتم تا استوکیومتری بخش نکات بخش اتم ۲ مراجعه کنید.
با سپاس از خانم مهندس سارا دالوند به دلیل طرح این پرسش
سرچشمه ها:
اپلیکیشن از اتم تا استوکیومتری
https://www.acs.org/content/dam/acsorg/education/whatischemistry/periodic-table-of-elements/acs-periodic-table-poster_download.pdf
https://www.wizeprep.com/textbooks/undergrad/chemistry/4017/sections/101189
https://www.toppr.com/guides/chemistry/structure-of-atom/electron-configuration/











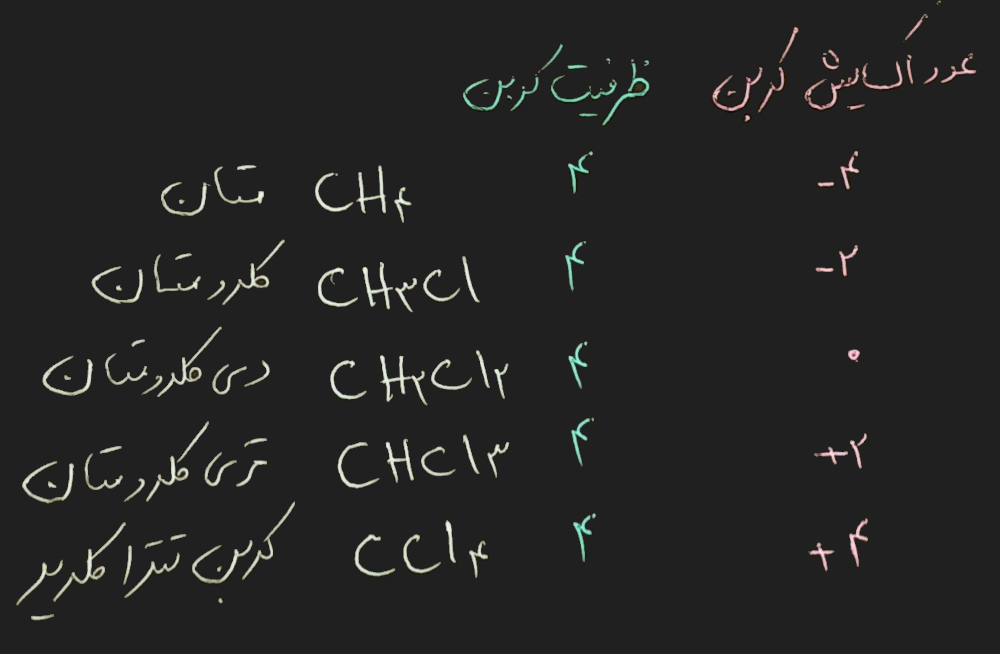





2 Comments
خیلی ممنونم از استاد عزیز
دستتون درد نکنه بابت اطلاعات بروزی که میدید