جرم اتمی متوسط

کانی های معدنی ۲
تیر ۲۳, ۱۳۹۷
کانی های معدنی ۳
مرداد ۷, ۱۳۹۷یکی از مفاهیمی که مد نظر طراحان کنکور است رابطه ی جرم اتمی میانگین با درصد فراوانی ایزوتوپ هاست.
به داوطلبان عزیز توصیه می شود که فقط از رابطه کلی زیر برای این نمونه تست ها استفاده شود:
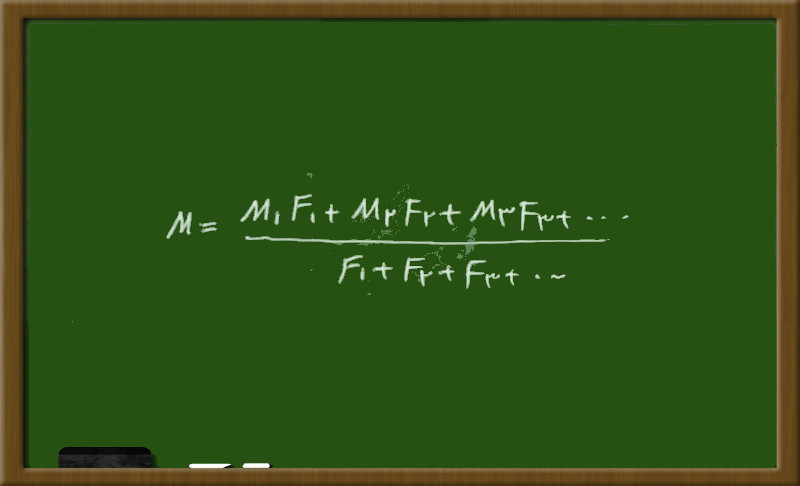
در رابطه بالا، M جرم اتمی میانگین M۱,M۲,M۳ جرم های اتمی و F۱,F۲,F۳ درصد فراوانی هر ایزوتوپ را نشان می دهد. اکنون تست تجربی خارج سال ۹۰ را بررسی می کنیم:
– عنصر ۱۸X با جرم اتمی میانگین ۳۶/۸ گرم بر مول دارای سه ایزوتوپ طبیعی است که یکی از آن ها دارای ۲۰ نوترون و فراوانی ۲۰٪ و دیگری ۱۸ نوترون با فراوانی ۷۰٪ است. شمار نوترون های ایزوتوپ دیگر کدام است؟
۱) ۲۱
۲) ۲۲
۳) ۲۳
۴) ۲۴
با توجه به این که در رابطه ی اشاره شده درصد فراوانی و جرم اتمی هر ایزوتوپ وجود دارد ابتدا برای هر ایزوتوپ با استفاده از نوترون و پروتون جرم اتمی هر ایزوتوپ را به دست می آوریم:
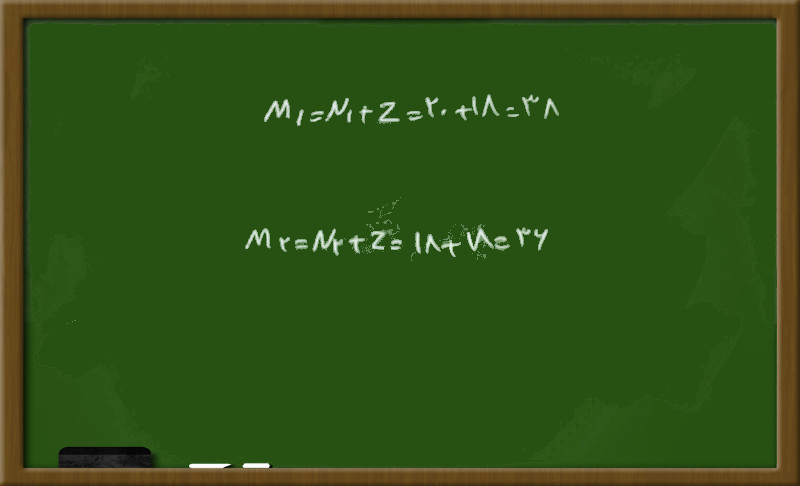
سپس با استفاده از فرمول جرم اتمی متوسط، ایزوتوپ سوم را حساب می کنیم:
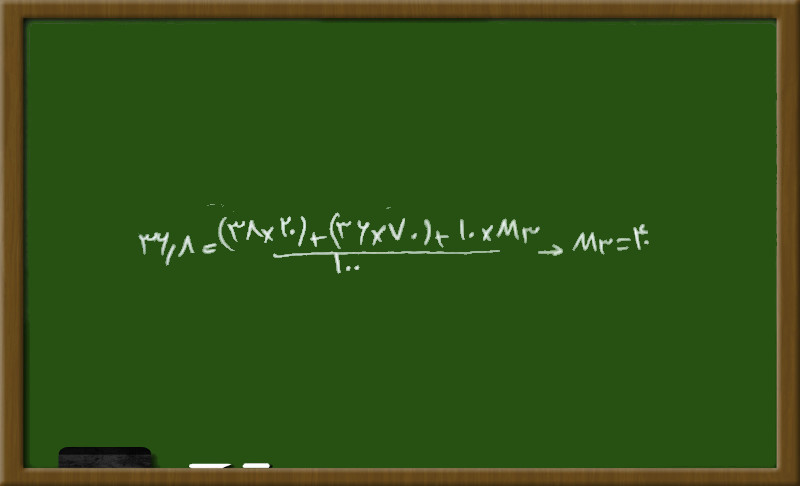
چون عدد اتمی برابر ۱۸ است پس نوترون ایزوتوپ دیگر ۲۲ می شود.
نوشته: ابوالفضل امیراعظمی
کارشناس ارشد شیمی فیزیک
برای سهولت در بازبینی وب سایت شیمی کیمیکال و ده ها وب سایت شیمی ایرانی و خارجی دیگر و شبکه های اجتماعی مرتبط و همچنین سهولت در به اشتراک گذاری مطالب آن ها اپلیکیشن رایگان کیمیکال پلاس را نصب کنید.






