انواع واکنش های شیمیایی

لیمونن (اسانس پوست پرتقال)
مرداد ۲۰, ۱۳۹۵
آب
شهریور ۱۸, ۱۳۹۵- kian kiani
- kiandroid.ir
- kimical.ir
- آب + اکسید فلزات قوی
- آب + اکسید نافلزات
- آمادگی کنکور شیمی
- آموزش شیمی
- اپلیکیشن شیمی
- اپلیکیشن های شیمی
- اکسیژن + فلز
- اکسیژن + نافلز
- انواع واکنش های شیمیایی
- برخی اسید ها اگر حرارت داده شوند به اکسید نافلز و آب تجزیه می شوند
- برخی اکسید ها در اثر حرارت تجزیه می شوند
- برخی مواد در اثر الکتریسیته تجزیه می شوند
- بیشتر هیدرو اکسید های فلزی وقتی گرم شوند به اکسید فلز و آب تجزیه می شوند
- تجزیه
- ترکیب
- ترکیب + عنصر
- تست شیمی
- تست های شیمی
- تقویتی شیمی
- تمرین های اضافی شیمی
- جانشینی دوگانه
- جانشینی ساده
- جانشینی هیدروژن آب با یک فلز فعال
- جانشینی یک فلز در یک ترکیب با یک فلز فعال تر
- حا مسائل شیمی یازدهم
- حل تمرین های شیمی دهم
- حل تمرین های شیمی یازدهم
- حل مسائل شیمی دهم
- درس شیمی
- سایت شیمی
- سایت های مفید شیمی
- سوالات کنکور شیمی
- شیمی
- شیمی دانشگاهی
- صنایع شیمی
- صنایع شیمیایی
- صنعت شیمی
- کربنات های فلزی وقتی گرم شوند اکسید فلز و کربن دی اکسید می دهند
- کلرات های فلزی وقتی حرارت داده شوند به کلرید فلز و اکسیژن تجزیه می شوند
- کنکور شیمی
- کیان دروید
- کیان کیانی
- کیمیکال
- نکات کنکوری شیمی
- نکته های کنکوری شیمی
- نمک + اسید
- نمک + باز
- نمک + نمک
- نمونه تمرین های شیمی
- نمونه مسائل شیمی شیمی پیش دانشگاهی
- واکنش بین اسید و باز
- وب سایت شیمی
- وبسایت های مفید شیمی
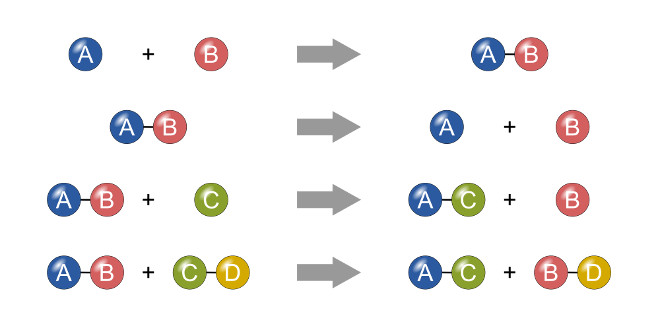
بیشتر واکنش های شیمیایی را در شیمی معدنی می توانیم به این چهار نوع زیر تقسیم بندی کنیم:
ترکیب

A + B → AB
اکسید فلز → اکسیژن + فلز
2Mg + O2 → 2MgO
——————————–
اکسید نافلز → اکسیژن + نافلز
C + O2 → CO2
——————————–
باز → آب + اکسید فلزات قوی -گروه ۱ و۲
Na2O + H2O → 2NaOH
MgO + H2O → Mg(OH)2
——————————–
اسید اکسیژن دار → آب + اکسید نافلزات
CO2 + H2O → H2CO3
——————————–
نمک → نافلز + فلز
2Na + Cl2 → 2NaCl
——————————–
برخی از نافلزات نیز با یکدیگر واکنش می دهند
2P + 3Cl2 → 2PCl3
——————————–
این دو واکنش را نیز باید به خاطر بسپارید
N2 + 3H2 → 2NH3
NH3 + H2O → NH4OH
تجزیه
AB → A + B
کربنات های فلزی وقتی گرم شوند اکسید فلز و کربن دی اکسید می دهند
CaCO3 → CaO + CO2
——————————–
بیشتر هیدرو اکسید های فلزی وقتی گرم شوند به اکسید فلز و آب تجزیه می شوند
Ca(OH)2 → CaO + H2O
——————————–
کلرات های فلزی وقتی حرارت داده شوند به کلرید فلز و اکسیژن تجزیه می شوند
2KClO3 → 2KCl + 3O2
——————————–
برخی اسید ها اگر حرارت داده شوند به اکسید نافلز و آب تجزیه می شوند
H2SO4 → H2O + SO3
——————————–
برخی اکسید ها در اثر حرارت تجزیه می شوند
2HgO → 2Hg + O2
——————————–
برخی مواد در اثر الکتریسیته تجزیه می شوند
2H2O → 2H2 + O2
2NaCl → 2Na + Cl2
جانشینی ساده
A + BX → AX + B
یا
AX + Y → AY + X
جانشینی یک فلز در یک ترکیب با یک فلز فعال تر به عبارت دیگر
عنصر + ترکیب → ترکیب + عنصر
Fe + CuSO4 → FeSO4 + Cu
——————————–
جانشینی هیدروژن آب با یک فلز فعال-فلزات گروه اول و دوم
عنصر + ترکیب → ترکیب + عنصر
هیدروژن + باز → آب + فلزات قوی(گروه ۱ و ۲)
2Na + 2H2O → 2NaOH + H2
Mg + H2O → MgO + H2
——————————–
جانشینی هیدروژن اسید با یک فلز فعال فلزات بالای هیدروژن در سری الکترو شیمیایی و باز
عنصر + ترکیب → ترکیب + عنصر
Zn + 2HCl → ZnCl2 + H2
——————————–
جانشینی یک نافلز در یک ترکیب با یک نافلز فعال تر باز هم
عنصر + ترکیب → ترکیب + عنصر
Cl2 + 2NaBr → 2NaCl + Br2
جانشینی دوگانه
AX + BY → AY + BX
تشکیل رسوب
نمک + نمک → نمک + نمک
NaCl + AgNO3 → NaNO3 + AgCl
BaCl2 + Na2SO4 → 2NaCl + BaSO4
——————————–
تشکیل گاز
اسید + نمک → نمک + اسید
HCl + FeS → FeCl2 + H2S
——————————–
باز + نمک → نمک + باز
NaOH + NH4Cl → NaCl + NH4OH
——————————–
تشکیل آب
اگر واکنش بین اسید و باز باشد، واکنش خنثی شدن نیز نامیده می شود
آب + نمک → باز + اسید
HCl + NaOH → NaCl + H2O
HNO3 + KOH → KNO3 + H2O
همیشه هم این طور نیست که نسبت های مولی یک به یک باشد:
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
——————————–
تشکیل یک فراورده همراه با تجزیه آن:
به طور کلی اگر یکی از فراورده ها کربنیک اسید باشد، آن به کربن دی اکسید و آب تجزیه می شود.
CaCO3 + HCl → CaCl2 + CO2 + H2O
لینک آموزش ویدیویی همین درسنامه
لینک عکسhttps://en.wikipedia.org/wiki/Chemical_reaction
اپلیکیشن معادله واکنش بساز و موازنه کن شامل ۱۰۰ تمرین از واکنش های بالا
دانلود اپلیکیشن رایگان معادله واکنش بساز و موازنه کن

از اتم تااستوکیومتری شامل آموزش فرمول نویسی که پیش نیاز مطالب بالا می باشد
برای سهولت در بازبینی وب سایت شیمی کیمیکال و ده ها وب سایت شیمی ایرانی و خارجی دیگر و شبکه های اجتماعی مرتبط و همچنین سهولت در به اشتراک گذاری مطالب آن ها اپلیکیشن رایگان کیمیکال پلاس را نصب کنید.








10 Comments
بسیار عالی
سپاس گزارم
ممنون
ایوووووووووووووووووووووووووووووووووووووووووووووووووول
خیلی با حال و کار آمد بود هیچ سایت دیگه ای اینطوری ننوشته بود
سپاس گزارم
برای فراگیری بهتر انواع واکنش ها از اپلیکیشن رایگان
معادله واکنش بساز و موازنه کن نیز استفاده کنید
http://www.kiandroid.ir/pcollection/reaction
سلامخسته نباشید من یه سوال داشتم
کتاب گفته بعضی از واکنش ها فقط توی یه دسته قرار نمیگیرن میشه یه واکنش بگین که توی دو دسته قرار بگیره؟
برای مثال
سوختن منیزیم ، یعنی اُکسایش(واکنش با اکسیژن).
.
نوعی ترکیب میتونه به حساب بیاد ، ولی…
ولی چون که نور و گرما شدید از خودش آزاد میکنه ، پس جزو دسته سوختن است!
سلام وقت بخیر لطفا یک راهنمایی راجع به اینکه در ساخت شوینده(مایع ظرفشویی) چرا بعد از اضافه کردن نمک بدون ید بجای اینکه مایع غلظت پیدا کند مایع بریده میشود(دو و یا سه فاز میشود).ممنون میشم راهنمایی کنید
بسیار مفید و جامع ?