سمینار شیمی سحابی ها
خرداد 14, 1404
جزوه قدیمی شیمی
مرداد 27, 1404تشکیل اکسیژن در کیهان، و استخراج آن در آزمایشگاه و در صنعت
اکسیژن موجود بر روی زمین که به صورت مخلوط با نیتروژن در هوا وجود دارد(یک پنجم هوا اکسیژن است) و همچنین به صورت گازهای کربن منو اکسید و کربن دی اکسید و بخار آب در هوا و در پوسته زمین به صورت آب یا ترکیب با عناصر دیگر موجود می باشد.
در این مقاله ابتدا به چگونگی پیدایش اکسیژن در کیهان و سپس به روش های آزمایشگاهی و صنعتی استخراج اکسیژن می پردازیم.
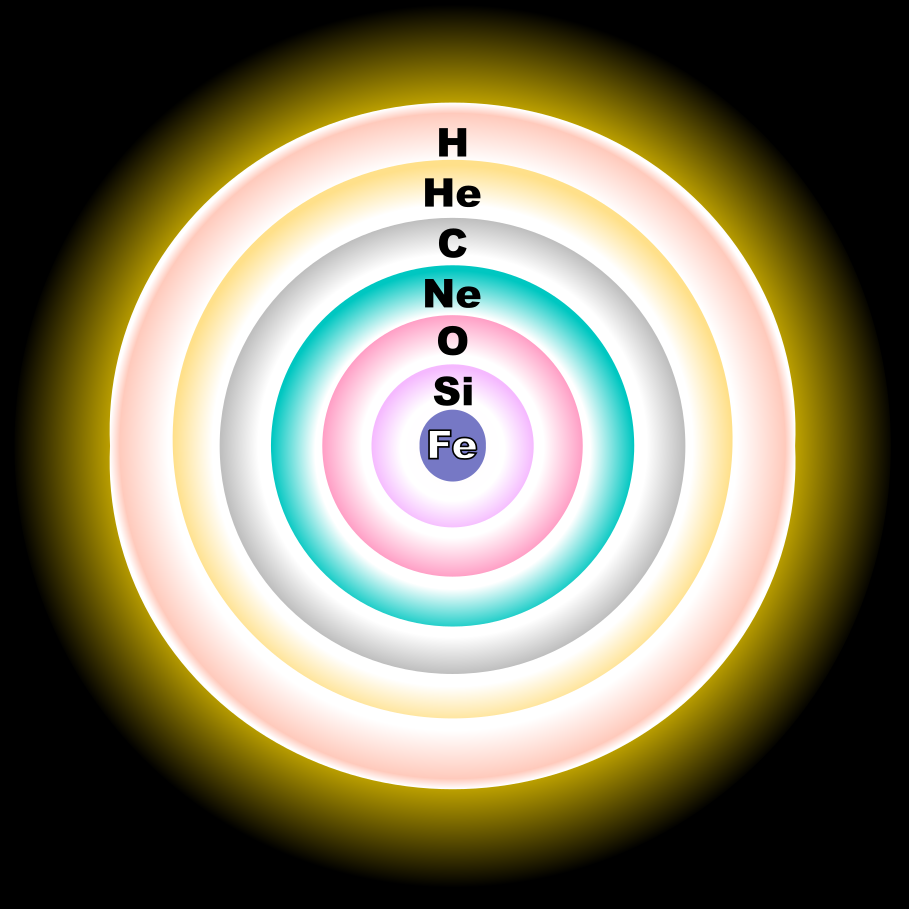
ایزوتوپها و منشأ ستارهای اکسیژن
ایزوتوپهای اکسیژن
اکسیژن طبیعی از سه ایزوتوپ پایدار16O, 17O و 18Oتشکیل شده است که 16O فراوانترین آنهاست (99.762٪ فراوانی طبیعی).
ایزوتوپ 16O یکی از محصولات غالب همجوشی در ستارگان عظیم است. این ایزوتوپ در پایان فرآیند همجوشی هلیوم با مقداری سنتز در فرآیند گداخت نئون سنتز میشود. هر دو 17O و 18O به هستههای بذر نیاز دارند. 17O در درجه اول با گداخت هیدروژن به هلیوم در طول چرخه CNO ساخته میشود و آن را به یک ایزوتوپ رایج در مناطق گداخت هیدروژن ستارگان تبدیل میکند. بیشتر 18O زمانی تولید میشود که 14N (که از گداخت CNO به وفور تولید میشود) یک هسته 14He را به دام میاندازد و 18O را در مناطق غنی از هلیوم ستارگان عظیم و تکاملیافته رایج میکند.
پانزده رادیوایزوتوپ شناسایی شدهاند که از 11O تا 28O متغیرند. پایدارترین آنها 15O با نیمه عمر 122.24 ثانیه و 14O با نیمه عمر 70.606 ثانیه هستند. تمام ایزوتوپهای رادیواکتیو باقیمانده نیمه عمری کمتر از 27 ثانیه دارند و اکثر آنها نیمه عمری کمتر از 83 میلیثانیه دارند. رایجترین حالت واپاشی ایزوتوپهای سبکتر از 16O واپاشی β+ برای تولید نیتروژن است و رایجترین حالت برای ایزوتوپهای سنگینتر از 18O واپاشی بتا برای تولید فلوئور است.
روشهای اصلی تولید اکسیژن در آزمایشگاه و صنعت
I. روشهای آزمایشگاهی
این روشها معمولاً مقادیر کمی اکسیژن تولید میکنند و برای آزمایشها، نمایشها یا تحقیقات در مقیاس کوچک استفاده میشوند.
۱. تجزیه حرارتی ترکیبات خاص:
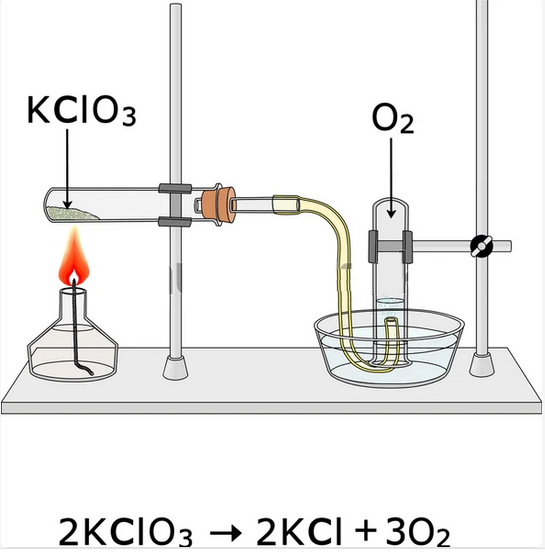
• تجزیه پتاسیم کلرات (KClO₃): این یک روش آزمایشگاهی کلاسیک است. هنگامی که پتاسیم کلرات در حضور کاتالیزور (معمولاً دیاکسید منگنز، MnO₂) به شدت گرم میشود، پتاسیم کلرات تجزیه میشود و گاز اکسیژن و پتاسیم کلرید (KCl) تولید میکند.
* واکنش:
2KClO₃(s) → 2KCl(s) + 3O₂(g)
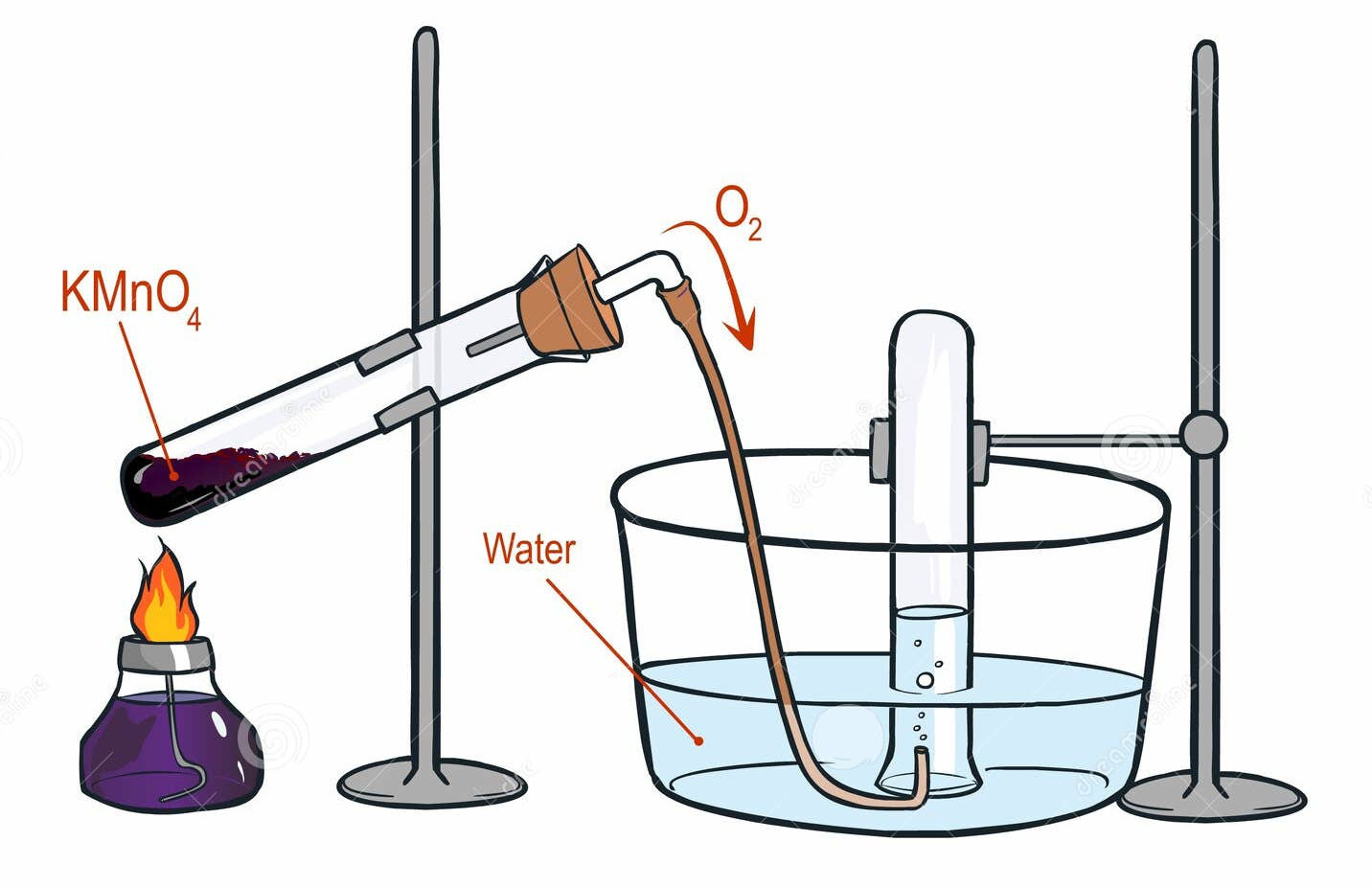
* توجه: دیاکسید منگنز به عنوان کاتالیزور عمل میکند و واکنش را سرعت میبخشد اما در فرآیند مصرف نمیشود. گرم کردن پتاسیم کلرات بدون کاتالیزور میتواند خطرناک باشد و منجر به تجزیه کنترل نشده شود. • تجزیه پرمنگنات پتاسیم (KMnO₄): حرارت دادن پرمنگنات پتاسیم، همراه با دی اکسید منگنز و منگنات پتاسیم، اکسیژن نیز تولید میکند.
* واکنش:
2KMnO₄(s) → K₂MnO₄(s) + MnO₂(s) + O₂(g)
• تجزیه اکسید جیوه (HgO): روش تاریخی (به دلیل سمیت جیوه، اکنون کمتر رایج است).
* واکنش:
2HgO(s) → 2 Hg(l) + O₂(g)
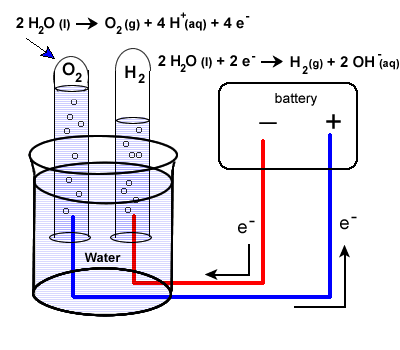
۲. الکترولیز آب:
• عبور جریان الکتریکی از آب باعث تجزیه آن به گاز هیدروژن در کاتد (الکترود منفی) و گاز اکسیژن در آند (الکترود مثبت) میشود.
• واکنش:
2H₂O(l) → 2H₂(g) + O₂(g)
• توجه: افزودن مقدار کمی الکترولیت (مانند اسید سولفوریک یا هیدروکسید سدیم) رسانایی آب را افزایش داده و الکترولیز را کارآمدتر میکند.
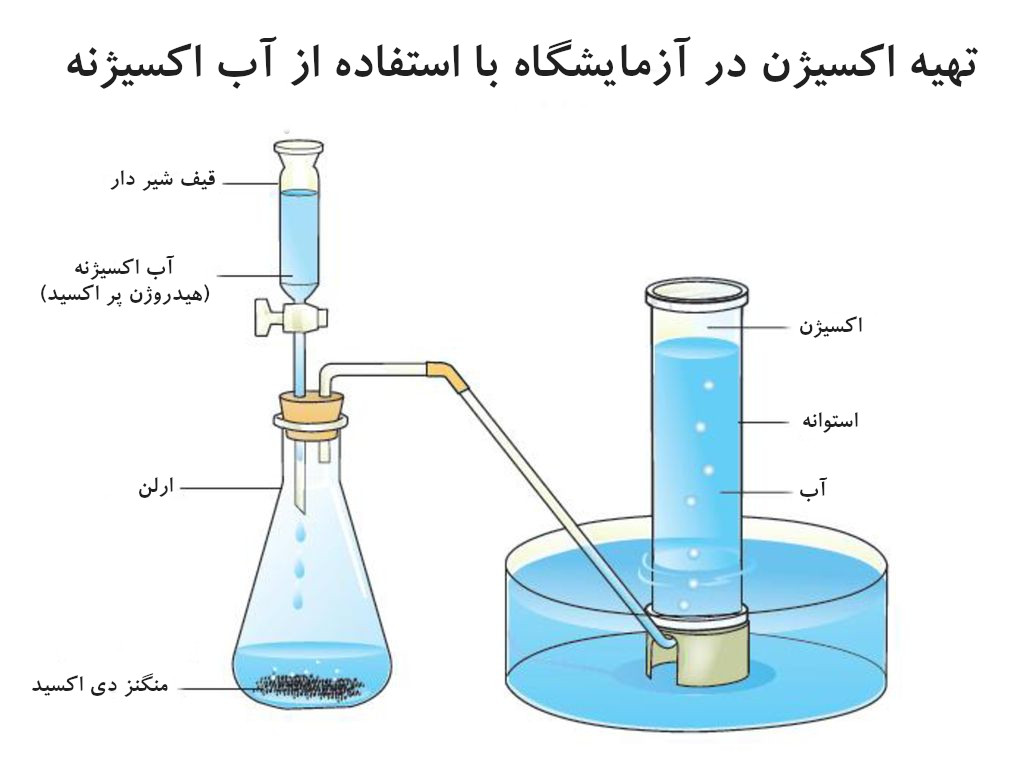
۳. واکنشهای شیمیایی شامل پراکسید هیدروژن (H₂O₂):
• پراکسید هیدروژن در حضور کاتالیزور (مانند دی اکسید منگنز، یدید پتاسیم) به آب و اکسیژن تجزیه میشود.
• واکنش:
2H₂O₂(aq) → 2H₂O(l) + O₂(g)
• توجه: این واکنش گرمازا است و میتواند بسیار شدید باشد، بنابراین کنترل سرعت افزودن کاتالیزور مهم است.
۴. تجزیه پراکسید سدیم (Na₂O₂):
• پراکسید سدیم با آب واکنش داده و گاز اکسیژن و هیدروکسید سدیم تولید میکند. • واکنش: 2
Na₂O₂(s) + 2 H₂O(l) → 4 NaOH(aq) + O₂(g)
II. روشهای صنعتی
این روشها برای تولید مقادیر زیادی اکسیژن برای کاربردهای مختلف صنعتی و پزشکی استفاده میشوند.
1. تقطیر جزء به جزء هوای مایع: این رایجترین روش صنعتی برای تولید اکسیژن است.
• فرآیند:
* ابتدا هوا فیلتر میشود تا گرد و غبار و سایر ناخالصیها از آن جدا شود.
* هوا خنک و فشرده میشود، سپس به سرعت منبسط میشود و باعث خنک شدن بیشتر آن میشود. این فرآیند تا زمانی که هوا مایع شود تکرار میشود.
* سپس هوای مایع تقطیر جزء به جزء میشود. نیتروژن نقطه جوش پایینتری (-196 درجه سانتیگراد) نسبت به اکسیژن (-183 درجه سانتیگراد) دارد، بنابراین ابتدا میجوشد و اکسیژن مایع نسبتاً خالص باقی میماند.
* سپس اکسیژن میتواند به صورت مایع ذخیره شود یا به صورت بخار به گاز تبدیل شود. • مزایا: نسبتاً ارزان است و میتواند مقادیر زیادی اکسیژن با خلوص بالا تولید کند.
• معایب: برای مایع کردن هوا به مقدار قابل توجهی انرژی نیاز دارد.
۲. جذب نوسان فشار (PSA):
• فرآیند:
* این روش از یک ماده جاذب جامد (مثلاً زئولیتها) برای جذب انتخابی نیتروژن از هوا در فشار بالا استفاده میکند.
* سپس گاز غنی شده با اکسیژن جمعآوری میشود.
* هنگامی که جاذب با نیتروژن اشباع میشود، فشار کاهش مییابد و نیتروژن آزاد میشود و جاذب برای یک چرخه دیگر احیا میشود.
• مزایا: سادهتر و از نظر انرژی کارآمدتر از تقطیر جزء به جزء، به ویژه برای تولید در مقیاس کوچکتر.
• معایب: اکسیژن با خلوص کمتری نسبت به تقطیر جزء به جزء تولید میکند (معمولاً حدود ۹۰-۹۵٪ خلوص). ۳. جداسازی غشایی:
• فرآیند:
* هوا از یک غشای نیمهتراوا عبور داده میشود که به طور انتخابی به اکسیژن اجازه میدهد راحتتر از نیتروژن عبور کند.
* این منجر به ایجاد یک جریان غنی از اکسیژن در یک طرف غشا میشود.
• مزایا: نسبتاً ساده و از نظر انرژی کارآمد، مناسب برای تولید در مقیاس کوچک تا متوسط.
• معایب: در مقایسه با سایر روشها، اکسیژن با خلوص نسبتاً کم تولید میکند.
سرچشمه ها:
https://www.nagwa.com/
https://www.wikiwand.com
https://sites.prairiesouth.ca/
https://www.dreamstime.com/