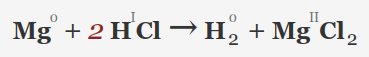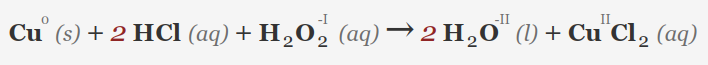واکنش سولفوریک اسید با فلزات
اردیبهشت ۱۰, ۱۴۰۴
بررسی ساخت طلا از واکنش های هسته ای
اردیبهشت ۱۴, ۱۴۰۴حلالیت فلزات در اسید هیدروکلریک (HCl) در درجه اول به موقعیت فلز در سری فعالیت شیمیایی(سری الکتروشیمیایی) و غلظت اسید بستگی دارد. با این حال، برخی از فلزات به طور قابل توجهی در برابر واکنش با هیدروکلریک اسید مقاوم هستند. هیدروکلریک اسید اگرچه یک اسید بسیار قوی است اما مانند نیتریک اسید و سولفوریک اسید یک اکسید کننده قوی نیست بنابر این با بسیاری از فلزات واکنش نمی دهد اما در مجاورت یک اکسیدکننده مانند آب اکسیژنه با برخی از فلزات واکنش می دهد. یا مثلآ در تیزآب (در مجاورت نیتریک اسید که یک اسید قوی همچنین اکسید کننده قوی است) حتی فلزات نجیب را هم حل می کند. در اینجا به تفکیک این واکنش ها را بررسی می کنیم:
فلزاتی به طور کلی در اسید هیدروکلریک نامحلول هستند:
• فلزات نجیب: این فلزات به دلیل واکنش پذیری کم و مقاومت در برابر اکثر اسیدها شناخته شده اند. اگر چه اسید کلریدریک یک اسید بسیار قوی است اما بر خلاف نیتریک اسید و سولفوریک اسید اکسید کننده قوی به شمار نمی آید ونمی تواند فلزات نجیب را اکسید و حل کند. این گروه شامل:
* طلا (Au)
* پلاتین (Pt)
* ایریدیوم (Ir)
* رودیوم (Rh)
* روتنیوم (Ru)
* اوسمیوم (Os)
* نقره (Ag)
(اگرچه همان طور که گفته شد فلزات بالا در تیزآب سلطانی حل می شوند)
سایر فلزات نسبتاً غیر فعال: این فلزات در حالی که کاملاً “نجیب” نیستند، مقاومت قابل توجهی در برابر اسید هیدروکلریک نشان می دهند:
* مس (مس): مس در دماهای بالاتر با HCl غلیظ به آرامی واکنش می دهد.
* جیوه (Hg): جیوه نسبتاً غیر فعال است و تا حد زیادی تحت تأثیر HCl قرار نمی گیرد.
* تانتالیم (Ta): تانتالیوم به دلیل مقاومت استثنایی در برابر خوردگی شناخته شده است.
فلزاتی که در اسید هیدروکلریک حل می شوند:
بسیاری از فلزات معمولی به آسانی با اسید هیدروکلریک واکنش داده و گاز هیدروژن (H2) و نمک کلرید فلز تولید می کنند. این شامل:
• فلزات قلیایی (Li، Na، K، Rb، Cs): این فلزات به شدت و گرمازا واکنش می دهند و گاز هیدروژن و کلریدهای فلزی مربوطه را تولید می کنند.
• فلزات قلیایی خاکی (Be، Mg، Ca، Sr، Ba): این فلزات نیز با HCl واکنش می دهند، اگرچه اغلب شدت کمتری نسبت به فلزات قلیایی دارند. بریلیم نسبتا کند واکنش نشان می دهد.
• روی (Zn): روی به راحتی در HCl حل می شود و کلرید روی (ZnCl2) و گاز هیدروژن تولید می کند.
• آهن (Fe): آهن با HCl واکنش داده و کلرید آهن (II) (FeCl2) و گاز هیدروژن را تشکیل می دهد.
• منگنز (Mn): منگنز با HCl واکنش می دهد.
• آلومینیوم (Al): آلومینیوم با HCl واکنش می دهد و کلرید آلومینیوم (AlCl3) و گاز هیدروژن را تشکیل می دهد.
• قلع (Sn): قلع در HCl حل می شود و قلع (II) کلرید (SnCl2) و گاز هیدروژن تولید می کند.
• سرب (Pb): سرب به آرامی با HCl واکنش می دهد و کلرید سرب (PbCl2) تا حدودی محلول است، بنابراین واکنش ممکن است محدود باشد.
یک نمونه از واکنش فلزات بالا با هیدروکلریک اسید:
ملاحظات مهم:
• غلظت اسید هیدروکلریک: HCl غلیظ عموماً سریعتر از HCl رقیق واکنش نشان می دهد.
• دما: دمای بالاتر اغلب سرعت واکنش را افزایش می دهد.
• حالت اکسیداسیون: حالت اکسیداسیون فلز در نمک کلرید حاصل می تواند بسته به فلز و شرایط متفاوت باشد. به عنوان مثال، آهن معمولاً در واکنش با HCl کلرید آهن(II) را تشکیل می دهد، اما حالت های اکسیداسیون بالاتر در شرایط مختلف امکان پذیر است.
• غیرفعال سازی: در حالی که با HCl معمول نیست، تشکیل یک اکسید یا لایه محافظ دیگر روی سطح فلز می تواند واکنش بیشتر را مهار کند.
• وجود اکسید کننده ها: افزودن یک عامل اکسید کننده (مانند پراکسید هیدروژن) به HCl می تواند واکنش پذیری برخی از فلزات را افزایش داده و به انحلال کمک کند. برای نمونه مس با هیدروکلریک اسید به تنهایی واکنش نمی دهد اما در حضور آب اکسیژنه طبق معادله زیر واکنش می دهد و مس(II) کلرید تولید می شود
• ترکیب آلیاژ: آلیاژها رفتار پیچیده ای دارند که به ترکیب آنها بستگی دارد.
خلاصه:
فلزات نجیب به طور کلی در اسید هیدروکلریک نامحلول در نظر گرفته می شوند. مس و جیوه به طور قابل توجهی مقاوم هستند و برخی دیگر ممکن است بسته به غلظت اسید، دما و سایر عوامل به آرامی یا جزئی واکنش نشان دهند. اکثر فلزات رایج دیگر به راحتی با هیدروکلراید واکنش داده و گاز هیدروژن و نمک کلرید فلز تولید می کنند. همیشه با احتیاط از اسید هیدروکلریک استفاده کنید، زیرا بسیار خورنده است.
سرچشمه ها:
https://www.examples.com/
https://chemequations.com