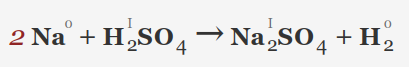
واکنش نیتریک اسید با فلزات
اردیبهشت 9, 1404
واکنش هیدروکلریک اسید با فلزات
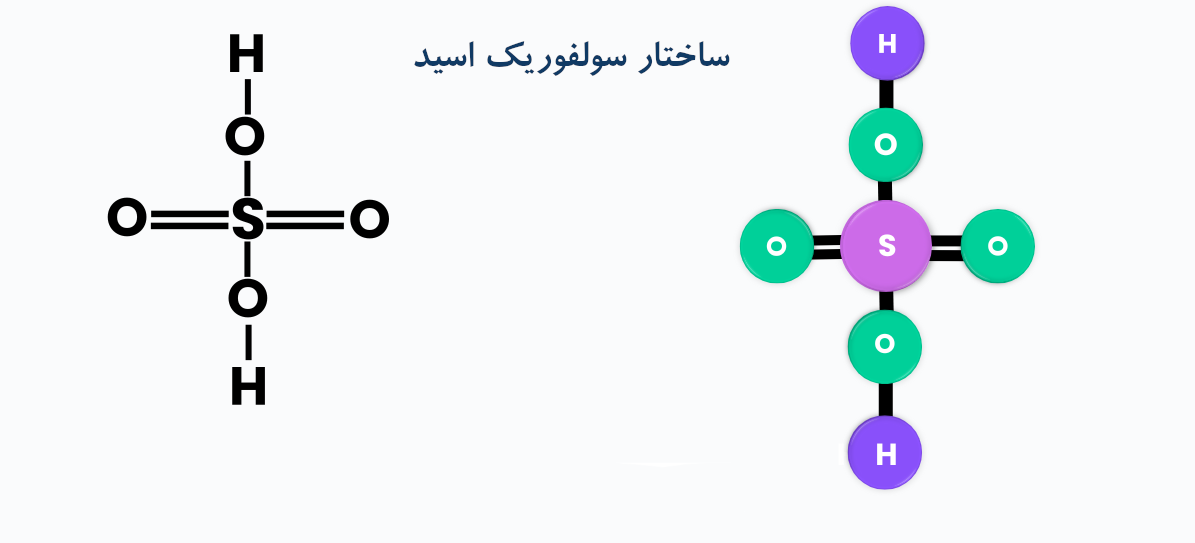
اردیبهشت 11, 1404سولفوریک اسید یکی از اسید های بسیار قوی می باشد. چون در این اسید گوگرد به بالاترین درجه اکسایش خود رسیده است بنابر این سولفوریک اسید یک اکسید کننده قوی نیز می باشد که این امر خورنده بودن آن را بیشتر می کند.
ساختار:
حلالیت فلزات در اسید سولفوریک (H2SO4) پیچیده است و به عوامل مختلفی بستگی دارد:
• غلظت اسید سولفوریک: اسید سولفوریک غلیظ یک عامل نمگیر(جاذب الرطوبه) و اکسید کننده قوی است، در حالی که اسید سولفوریک رقیق در درجه اول به عنوان یک اسید عمل می کند.
• دما: دماهای بالاتر به طور کلی سرعت واکنش را افزایش می دهد.
• موقعیت فلز در سری واکنش پذیری: فلزات بالاتر در سری واکنش پذیری (مثلاً فلزات قلیایی) راحت تر واکنش نشان می دهند.
• تشکیل نمک های نامحلول یا لایه های اکسیدی: تشکیل یک نمک سولفات نامحلول یا یک لایه اکسید محافظ می تواند فلز را غیرفعال کرده و از انحلال بیشتر جلوگیری کند.
در اینجا رفتار فلز در اسید سولفوریک را مورد تجزیه و تحلیل قرار می دهیم:
فلزات به طور کلی نامحلول در اسید سولفوریک (یا بسیار مقاوم):
• طلا (Au): طلا یک فلز نجیب و بسیار غیر فعال است. در اسید سولفوریک حل نمی شود.
• پلاتین (Pt): پلاتین یکی دیگر از فلزات نجیب است و مقاومت آن در برابر خوردگی استثنایی است که این امر آن را در اسید سولفوریک نامحلول می کند.
• ایریدیوم (Ir): مانند پلاتین، ایریدیوم بسیار غیر فعال است و در اسید سولفوریک حل نمی شود.
• رودیوم (Rh): یکی دیگر از فلزات نجیب شناخته شده و بی اثر است.
• روتنیوم (Ru): این فلز نیز در برابر اسید سولفوریک مقاوم است.
• اوسمیوم (Os): این نیز یک فلز نجیب و غیر فعال نسبت به اسید سولفوریک است.
• پالادیوم (Pd): پالادیوم مقاومت قابل توجهی در برابر اسید سولفوریک نشان می دهد.
فلزاتی که در اسید سولفوریک رقیق حل می شوند:
• فلزات قلیایی (Li, Na, K, Rb, Cs): این فلزات به شدت با اسید سولفوریک رقیق واکنش داده و گاز هیدروژن و سولفات فلز مربوطه را تولید می کنند. واکنش بسیار گرمازا است.
• فلزات قلیایی خاکی (Be, Mg, Ca, Sr, Ba): این فلزات همچنین با اسید سولفوریک رقیق واکنش می دهند، اگرچه عموماً شدت کمتری نسبت به فلزات قلیایی دارند. در این واکنش گاز هیدروژن و سولفات فلز تولید می شود. با این حال، برخی از سولفات های قلیایی خاکی (مانند سولفات باریم) نسبتا نامحلول هستند و این می تواند میزان واکنش را محدود کند یا یک لایه غیرفعال تشکیل دهد.
• روی (Zn): روی به راحتی در اسید سولفوریک رقیق حل می شود و سولفات روی و گاز هیدروژن تولید می کند.
• آهن (Fe): آهن در اسید سولفوریک رقیق حل می شود و سولفات آهن (FeSO4) و گاز هیدروژن را تشکیل می دهد.
• منگنز (Mn): منگنز در اسید سولفوریک رقیق حل می شود.
• نیکل (Ni): نیکل در اسید سولفوریک رقیق حل می شود.
• قلع (Sn): قلع در اسید سولفوریک رقیق حل می شود.
• سرب (Pb): سرب به آرامی با اسید سولفوریک رقیق واکنش می دهد. سولفات سرب (II) (PbSO4) نسبتاً نامحلول است و می تواند یک پوشش روی سطح ایجاد کند و واکنش بیشتر را کاهش دهد.
فلزاتی که در اسید سولفوریک غلیظ حل می شوند (اغلب با نتایج متفاوت):
• مس (Cu): اسید سولفوریک غلیظ به دلیل خواص اکسید کننده قوی می تواند با مس واکنش داده و سولفات مس (II) و گاز دی اکسید گوگرد (SO2) تولید کند.
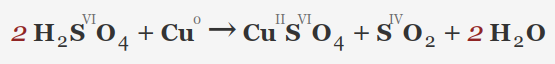
• نقره (Ag): نقره به طور کلی غیر فعال است، اما اسید سولفوریک بسیار غلیظ و داغ می تواند به آرامی آن را اکسید کند.
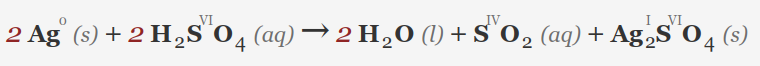
• آهن (Fe): اسید سولفوریک غلیظ در ابتدا می تواند آهن را غیرفعال کند. با این حال، تحت شرایط مناسب، همچنین می تواند واکنش نشان دهد و سولفات آهن (III) تشکیل دهد، اغلب با تولید گاز SO2.
یرخی از واکنش های آهن با سولفوریک اسید در رایط مختلف از نظر غلظت اسید و دما به شکل زیر است.

• بسیاری دیگر: بسیاری از فلزاتی که در اسید سولفوریک رقیق حل می شوند با اسید سولفوریک غلیظ نیز واکنش نشان می دهند، اما محصولات ممکن است به دلیل خواص اکسید کننده قوی اسید غلیظ متفاوت باشند. این واکنش ها اغلب شامل تولید دی اکسید گوگرد (SO2) یا حتی سولفید هیدروژن (H2S) در دماهای بالا است. ( در واکنش های بالا نشان داده شده است)
ملاحظات مهم:
• غیرفعال سازی(Passivation): تشکیل یک نمک سولفات نامحلول یا لایه اکسید روی سطح فلز می تواند به میزان قابل توجهی انحلال بیشتر را کاهش دهد یا حتی از آن جلوگیری کند. این امر به ویژه برای فلزاتی مانند سرب بسیار مهم است.
• حالت های اکسیداسیون: حالت اکسیداسیون فلز تولید شده در واکنش می تواند با غلظت اسید متفاوت باشد. به عنوان مثال، سولفات آهن (II) به احتمال زیاد با اسید رقیق تشکیل می شود، در حالی که سولفات آهن (III) اغلب با اسید غلیظ تشکیل می شود.
• ایمنی: اسید سولفوریک غلیظ بسیار خورنده است و می تواند باعث سوختگی شدید شود. همیشه با احتیاط شدید با آن رفتار کنید و از تجهیزات حفاظت فردی مناسب (PPE) از جمله عینک ایمنی، دستکش و روپوش آزمایشگاهی استفاده کنید.
به طور خلاصه، در حالی که برخی از فلزات نجیب به طور کامل با اسید سولفوریک واکنش نمی دهند، اکثریت قریب به اتفاق فلزات بسته به غلظت اسید، دما و همچنین توانایی تشکیل لایههای سولفات یا اکسید حاصل برای تشکیل لایههای غیرفعال که از واکنش بیشتر جلوگیری میکند، واکنشپذیریهای متفاوتی نشان میدهند. اسید سولفوریک رقیق در درجه اول به عنوان اسید عمل می کند، در حالی که اسید سولفوریک غلیظ هم به عنوان یک اسید و هم به عنوان یک عامل اکسید کننده قوی عمل می کند که منجر به محصولات واکنش متفاوت می شود.
سرچشمه ها:
https://www.examples.com/chemistry/sulfuric-acid.html
https://chemequations.com/