تیال ها، تیون ها
مهر 17, 1404
انواع سحابیها
مهر 19, 1404داستان جرم اتمی: نقص جرم، ایزوتوپها و استانداردهای اتمی
از هیدروژن دالتون تا کربن-۱۲ و کشف نقص جرم
نویسنده: حانیه مرادی دانشجوی علوم کامپیوتر کاربردی
مقدمه
در آغاز علم شیمی، دانشمندان رویای جهانی منظم را در سر داشتند که در آن اجزای سازندهی ماده از قواعد سادهای پیروی کنند. آنها اتمها را بهعنوان ذرات یکسان و تجزیهناپذیر تصور میکردند که جرمهایشان بهصورت نسبتهای عدد صحیح مرتب است. اما با دقیقتر شدن آزمایشها، این تصویر ساده ترکهایی برداشت؛ جرمها دقیقاً با انتظارات همخوانی نداشتند و رازهای عمیقتری را آشکار کردند. طی یک قرن، این معماها اسرار اتم را فاش ساختند، از ساختار داخلیاش تا انرژیای که آن را به هم متصل میکند. بیایید این مسیر را بهترتیب تاریخی دنبال کنیم و مفاهیم را گامبهگام، همانگونه که کشف شدند، بررسی کنیم تا ببینیم چگونه به مفاهیم امروزی مانند واحد جرم اتمی، ایزوتوپها، نقص جرم و انرژی پیوند هستهای رسیدیم.
۱. ایدههای اولیه درباره وزن اتمی (۱۸۰۳–۱۸۱۶)
در اوایل قرن نوزدهم، مفهوم اتم تازه در حال شکلگیری بود. جان دالتون، شیمیدان انگلیسی، بین سالهای ۱۸۰۳ تا ۱۸۰۸ پیشنهاد کرد که همهی مواد از ذرات ریز و تجزیهناپذیری به نام اتم ساخته شدهاند. او معتقد بود هر عنصر اتمهای یکسانی دارد و اتمهای عناصر مختلف وزنهای متفاوتی دارند. در آن زمان، هیچکس از ساختار داخلی اتمها، یعنی پروتون، نوترون، الکترون یا هسته، اطلاعی نداشت. اتمها بهعنوان کرههای جامد و غیرقابلشکست تصور میشدند.
شیمیدانها نمیتوانستند اتمها را بهصورت جداگانه وزن کنند، چون بیش از حد کوچک بودند. بهجای آن، با اندازهگیری دقیق نسبت واکنش عناصر در واکنشهای شیمیایی، وزنهای نسبی را محاسبه کردند. هیدروژن، سبکترین عنصر شناختهشده، بهعنوان پایه با وزن ۱ انتخاب شد و بقیه عناصر با آن مقایسه شدند. برای مثال، اگر ۱ واحد هیدروژن با ۸ واحد اکسیژن ترکیب میشد تا آب بسازد (طبق اندازهگیریهای آن زمان)، وزن اتمی اکسیژن ۸ تعیین میشد. دالتون فرض کرد فرمول آب HO است (قبل از اینکه فرمول درست H₂O مشخص شود)، بنابراین وزن نسبی اکسیژن ۸ برابر هیدروژن شد.
دالتون و دیگران گمان میکردند این وزنها اعداد صحیح سادهای هستند، مثلاً مضربهایی از وزن هیدروژن. در سالهای ۱۸۱۵–۱۸۱۶، ویلیام پرات، پزشک و شیمیدان، فرضیهای مطرح کرد که همه اتمها از بستهبندی اتمهای هیدروژن ساخته شدهاند و وزنهایشان باید اعداد صحیح باشند. این «فرضیه پرات» با توجه به ابزارهای ساده آن زمان، مثل ترازوهای ابتدایی و آزمایشهای چگالی گاز، منطقی به نظر میرسید، چون مقادیر نزدیک به اعداد صحیح بودند و هر ناسازگاری به خطای آزمایش نسبت داده میشد.
۲. اصلاح وزنهای اتمی و کشف ناسازگاریها (اواسط قرن ۱۹ تا اوایل قرن ۲۰)
با پیشرفت شیمی در قرن نوزدهم، آزمایشها دقیقتر شدند. شیمیدانها از روشهایی مثل تجزیه گرانسنجی (وزن کردن محصولات واکنشها) و اندازهگیری چگالی گاز برای اصلاح وزنهای نسبی اتمی استفاده کردند. اما اعداد همیشه بهصورت صحیح درنمیآمدند. مثلاً وزن اتمی کلر حدود ۳۵.۵ بود، نه ۳۵ یا ۳۶. ابتدا این کسرها به خطاهای اندازهگیری نسبت داده شد، اما ناسازگاریها ادامه یافت.
در اواخر قرن نوزدهم، اکسیژن بهجای هیدروژن بهعنوان استاندارد مرجع انتخاب شد، چون با عناصر زیادی ترکیبات پایدار میساخت و اندازهگیری را آسانتر میکرد. وزن اکسیژن ۱۶ تعیین شد. اما شیمیدانها و فیزیکدانها گاهی استانداردهای کمی متفاوتی استفاده میکردند؛ شیمیدانها از میانگین اکسیژن موجود در هوا (شامل ایزوتوپها) استفاده میکردند، درحالیکه فیزیکدانها روی شکل خاصی از اکسیژن تمرکز داشتند، که باعث اختلافات جزئی میشد.
با این حال، وزنهای اتمی همچنان اعداد نسبی بودند، نه جرمهای مطلق بر حسب گرم. هنوز کسی نمیدانست چرا اعداد غیرصحیح ظاهر میشوند، چون ساختار داخلی اتم و ایزوتوپها ناشناخته بود.
۳. کشف ساختار داخلی اتم (۱۸۹۷–۱۹۳۲)
در اوایل قرن بیستم، اکتشافات جدیدی ایده اتم تجزیهناپذیر را درهم شکست. در سال ۱۸۹۷، جی.جی. تامسون با آزمایش لولههای پرتو کاتدی، الکترون را کشف کرد و نشان داد که اتمها حاوی ذرات با بار منفی هستند. این ثابت کرد که اتمها قابلتجزیهاند.
در سال ۱۹۱۱، آزمایش ورقه طلای ارنست رادرفورد -پراکندگی ذرات آلفا (هسته هلیوم) از فلز نازک- نشان داد که اتمها هستهای کوچک و چگال در مرکز دارند که توسط الکترونها احاطه شده و بیشتر جرم اتم در آنجاست.
در سال ۱۹۱۳، فردریک سادی واژه «ایزوتوپ» را ابداع کرد، وقتی متوجه شد برخی عناصر، مثل محصولات واپاشی اورانیوم، اتمهایی با خواص شیمیایی یکسان اما جرمهای متفاوت دارند. رادرفورد در سال ۱۹۱۹ پروتون را بهعنوان ذره با بار مثبت در هسته (هسته هیدروژن) شناسایی کرد. سرانجام، در سال ۱۹۳۲، جیمز چادویک نوترون را کشف کرد، ذرهای خنثی با جرمی مشابه پروتون. حالا هسته بهعنوان مجموعهای از پروتونها و نوترونها (بهصورت کلی به نام نوکلئون) شناخته شد.
ایزوتوپها اتمهایی از یک عنصر هستند که تعداد پروتونهایشان یکسان است، اما تعداد نوترونهایشان متفاوت است. عناصر در طبیعت ترکیبی از ایزوتوپها با جرمهای کمی متفاوت هستند. ابزارهایی مثل طیفسنجی پرتو ایکس (توسط هنری موزلی در ۱۹۱۳) تعداد پروتونها (عدد اتمی) را مشخص کرد و عناصر را بهدرستی متمایز کرد.
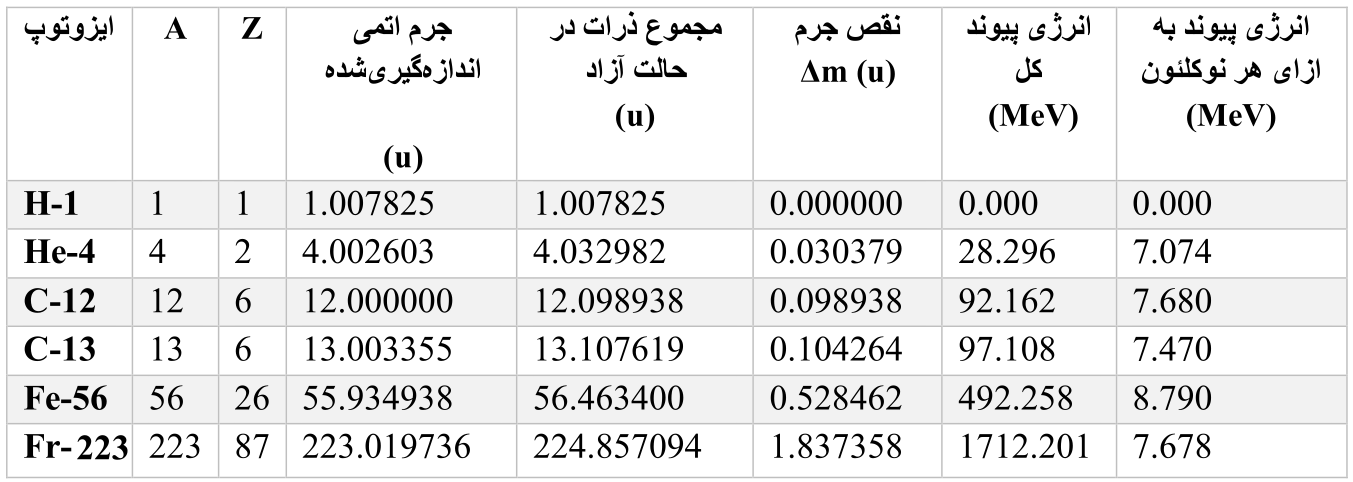
۴. اندازهگیری دقیق جرم و معمای جرم گمشده (۱۹۱۹–۱۹۲۲)
با شناخته شدن هسته، دانشمندان به روشهای بهتری برای اندازهگیری جرم اتمها نیاز داشتند. در سال ۱۹۱۹، فرانسیس استون دستگاه طیفسنج جرمی را اختراع کرد که با استفاده از میدانهای مغناطیسی، اتمها را بر اساس جرمشان جدا میکرد، مثل ترازویی دقیق برای ایزوتوپها.
اندازهگیریهای استون، زمانی که اکسیژن به عنوان مرجع جرم استفاده میشد، نشان داد که جرم ایزوتوپها نزدیک به اعداد صحیح است، اما نه دقیقاً (بهجز ایزوتوپ مرجع واحد). نکته جالبتر اینکه جرم هسته همیشه کمی کمتر از مجموع جرم پروتونها و نوترونهای جداگانه بود. مثلاً هلیوم- ۴ (۲ پروتون + ۲ نوترون) باید حدود ۴.۰۳۳ واحد (در واحد جرم اتمی امروزی بر أساس کربن که بعدتر به آن پراختهخواهد شد) وزن داشتهباشد، اما ۴.۰۰۲۶ واحد است؛ مقدار کمی از جرم گم میشود.
این «جرم گمشده» ابتدا یک معما بود. چرا جرم هستهها دقیقاً مجموع اجزای آنها نبود؟
۵. توضیح نقص جرم با نسبیت اینشتین (دهههای ۱۹۲۰–۱۹۳۰)
پاسخ از نظریه نسبیت خاص اینشتین در سال ۱۹۰۵ آمد که میگفت E=mc²، یعنی جرم و انرژی قابلتبدیل به یکدیگرند. در دهههای ۱۹۲۰ و ۱۹۳۰، فیزیکدانها فهمیدند وقتی پروتونها و نوترونها در هسته به هم متصل میشوند، انرژی آزاد میکنند؛ نیروی هستهای قوی آنها را محکم نگه میدارد و مقدار کمی از جرم به انرژی پیوند تبدیل میشود.
این جرم ازدسترفته «نقص جرم» (Δm) نامیده شد. انرژی معادل آن، انرژی پیوند هستهای است که برای شکستن هسته باید تأمین شود. این پیوند باعث «از دست رفتن» جرم میشود.
استون و دیگران با استفاده از طیفسنج جرمی این را تأیید کردند. با کشف نوترون توسط چادویک در ۱۹۳۲، محاسبات دقیقتر شد. نقص جرم کوچک اما قابلاندازهگیری است و بسته به عنصر متفاوت است. یعنی هسته هر عنصر با نرخ متفاوتی دچار نقص جرم میشود. هر هسته بسته به تعداد پروتونها و نوترونها و نحوه آرایش آنها، انرژی پیوند هستهای متفاوتی دارد که از طریق نیروی هستهای قوی ایجاد میشود و انرژی پیوند به ازای هر نوکلئون (پروتون یا نوترون) برای عناصر مختلف فرق میکند.
۶. تعریف واحد جهانی: واحد جرم اتمی (amu) و کربن-۱۲ (۱۹۶۱)
اندازهگیری جرم مطلق به گرم غیر کاربردی بود؛ یک اتم کربن حدود ۱.۹۹×۱۰⁻۲۳ گرم جرم دارد. بنابراین، دانشمندان به مقیاس نسبی نیاز داشتند. واحد جرم اتمی amu یا u، که به آن دالتون هم میگویند برای راحتی ایجاد شد.
ابتدا (قرن نوزدهم) این واحد بر اساس هیدروژن=۱ بود. در اوایل قرن بیستم، اکسیژن=۱۶ استفاده شد، اما به دلیل وجود فراوان ایزوتوپها ناسازگاریهایی پیش آمد. در سال ۱۹۶۱، اتحادیه بینالمللی شیمی و فیزیک محض و کاربردی (IUPAC) و (IUPAP) آن را یکسان کردند: amu۱ دقیقاً یک دوازدهم جرم اتم خنثی کربن-۱۲ است. (معادل حدود ۱.۶۶۱×۱۰⁻۲۴ گرم) اتمی با ۶ پروتون. ۶ نوترون و ۶ الکترون.
چرا کربن-۱۲؟ چون ایزوتوپی پایدار و رایج است، در طبیعت فراوان است و برای شیمی (ترکیبات آلی) و فیزیک (طیفسنجی جرمی) مفید است. این تعریف نقص جرم را در خود جا دادهاست، زیرا بر اساس هسته واقعی و متصل است، نه ذرات آزاد.
• جرم پروتون آزاد ≈ ۱.۰۰۷۳ u
• جرم نوترون آزاد ≈ ۱.۰۰۸۷ u
این مقادیر کمی بیشتر از u۱ هستند، زیرا مقیاس کربن-۱۲، انرژی پیوند و از دست رفتن جرم را در خود جای داده است و این مقادیر در واقع نسبت به ذرات کربن پس از پیوند اندازه گیری میشوند. جرم الکترون (۰.۰۰۰۵۴۸)نیز ناچیز است اما در اتمهای خنثی لحاظ میشود. اما با اینحال جرم اتمی حتی در اتمهای با تعداد پروتون و نوترون و الکترون برابر، عدد صحیح نیست چرا همانطور که ذکر شد، هسته هر عنصر بسته به آرایش آن، با نرخ متفاوتی دچار نقص جرم میشود. در واقع،u ۱ تقریباً برابر است با یک دوم مجموع جرم یک پروتون و یک نوترون به اضافهی یکدوم جرم یک الکترون در کربن-۱۲ (۶ پروتون + ۶ نوترون + ۶ الکترون)، که پس از کسر نقص جرم به دست میآید. اگر نرخ نقص جرم برای همه هستهها ثابت بود و اتمها از الگویی یکسان در تعداد پروتونها، نوترونها و الکترونها پیروی میکردند، انتظار میرفت جرم اتمی ایزوتوپهایی با تعداد نوکلئونها و الکترونهای برابر (مثلاً هلیوم-۴ با ۴ نوکلئون) در این مقیاس دقیقاً عدد صحیح باشد. اما این اتفاق نمیافتد، زیرا انرژی پیوند هستهای، که به نیروی هستهای قوی و آرایش پروتونها و نوترونها بستگی دارد، در هر هسته متفاوت است. این تفاوت باعث میشود نرخ نقص جرم (مقدار جرمی که به ازای هر نوکلئون به انرژی پیوند تبدیل میشود) برای هر ایزوتوپ خاص فرق کند.
۷. عدد جرمی، ایزوتوپها و میانگین وزنی در دنیای مدرن
با شناخت هسته، عدد جرمی (A) بهعنوان مجموع پروتونها و نوترونها (N) و همچنین ( Z، عدد اتمی) تعریف شد.
: A = Z + N این عدد همیشه صحیح است و یک ایزوتوپ خاص را مشخص میکند، مثل:
C-12 (A=12, Z=6, N=6)
یا
C-13 (A=13, Z=6, N=7)
جرم اتمی در جدول تناوبی استاندارد، نه جرم یک ایزوتوپ خاص است، نه عدد جرمی، و نه حتی میانگین وزنی عددهای جرمی ایزوتوپها؛ بلکه میانگین وزنی جرم اتمی تمام ایزوتوپهای طبیعی بر اساس فراوانی آنهاست. عدد جرمی معمولاً میانگین گرفته نمیشود، چون مقداری اندازهگیریشده مثل جرم مقدار فیزیکی قابل استفاده نیست.
اتحادیه بینالمللی شیمی محض و کاربردی (IUPAC) بهطور دورهای جرمهای اتمی را بر اساس دقیقترین اندازهگیریها بهروزرسانی میکند. مقادیر جدول تناوبی امروزی (مثلاً تا سال ۲۰۲۵) از منابعی مثل گزارش فنی IUPAC 2023 یا پایگاه داده NIST میآیند که از طیفسنجی جرمی با دقت بالا استفاده میکنند.
مثال کربن:
• Carbon-12: ~98.9%, – 12.0000 u (دقیق بر اساس تعریف)
• Carbon-13: ~1.1%, – 13.0034 u
• میانگین وزنی:
(0.989 × 12) + (0.011 × 13.0034)≈12.011u
مثال آهن:
• ⁵⁴Fe: ~5.845%, – 53.939609 u
• ⁵⁶Fe: ~91.754%, – 55.934936 u
• ⁵⁷Fe: ~2.119%, – 56.935393 u
• ⁵⁸Fe: ~0.282%, – 57.933274 u
• میانگین وزنی:
(0.05845 × 53.939609) + (0.91754 × 55.934936) + (0.02119 × 56.935393) + (0.00282 × 57.933274) ≈ 55.845 u
این موارد توضیح میدهند که چرا اعداد غیرصحیح هستند: هم تاثیر نقص جرم (چه در محاسبهu وچه تاثیر تفاوت نرخ نقص جرم برای هر اتم) وهم ترکیب ایزوتوپهای طبیعی با هم.
۸. محاسبه نقص جرم و انرژی پیوند
برای اتم خنثی: Δm = [Z × جرم پروتون + N × جرم نوترون + Z × جرم الکترون] – جرم اتمی اندازهگیریشده
انرژی پیوند = Δm (u) × 931.494 MeV/u (E=mc²تبدیل از )
انرژی پیوند به ازای هر نوکلئون= انرژی پیوند کل / A
مثال (با مقادیر استاندارد؛ H-1 نقص جرم صفر دارد چون تک پروتونی و بدون نوترون است)
مقادیر تقریبیاند.
۹. الگویابی در انرژی های پیوند و کاربردها در دنیای واقعی
انرژی پیوند به ازای هر نوکلئون در عناصر سبک (مثل H-1 با ۰) کم است، در هلیوم-۴ بهسرعت افزایش مییابد، در آهن-۵۶ به اوج میرسد و برای عناصر سنگینتر کمی کاهش مییابد. این الگو موارد زیر را توضیح میدهد:
• همجوشی: هستههای سبک (مثل هیدروژن به هلیوم در ستارگان) با ترکیب شدن انرژی آزاد میکنند وانرژی پیوند به ازای نوکلئون را افزایش میدهند و به ثبات بیشتری میرسند.
• شکافت: هستههای سنگین (مثل اورانیوم) با شکافتن به سمت قله آهن انرژی آزاد میکنند. نقص جرم مطلق با افزایش A رشد میکند، اما به ازای هر نوکلئون روند نسبتا پایداری را دنبال میکند.
این اندازهگیریها E=mc² را به دست نیاوردهاند اما تأییدش میکنند: جرم «گمشده» ضرب در c² دقیقاً با انرژی پیوند آزادشده یا موردنیازبرای واکنش هستهای مطابقت دارد.
۱۰. جمعبندی
جرم اتمی قصهای از کنجکاوی علمی را بازگو میکند، از تصورات ساده دالتون درباره اتمهای یکسان تا کشف پیچیدگیهای هستهای امروزی. عدد جرمی نوکلئونها را بهصورت عدد صحیح میشمارد، اما جرم اتمی به علت نقص جرم و تفاوتهای آن همچنین وجود ایزوتوپها، اغلب کسری است. واحد جرم اتمی (u) بر پایه کربن-۱۲ تعریف شده تا این اثرات را در بر بگیرد. نقص جرم و انرژی پیوند هستهای نشان میدهند که چگونه طبیعت جرم را به انرژی پیوند هستهای تبدیل میکند؛ از نیروی ستارگان تا راز پایداری اتمها. این اکتشافات نهتنها معماهای اولیه را حل کرد، بلکه درهای علم هستهای را به روی ما گشود.
References:
1. Dalton, J. A New System of Chemical Philosophy. Manchester: R. Bickerstaff, 1808.
2. Prout, W. “On the Relation Between the Specific Gravities of Bodies in Their Gaseous State and the Weights of Their Atoms.” Annals of Philosophy, 1815–1816.
3. Stas, J. S. “Recherches sur les Poids Atomiques.” Annales de Chimie et de Physique, 1860.
4. Thomson, J. J. “Cathode Rays.” Philosophical Magazine, 1897.
5. Rutherford, E. “The Scattering of α and β Particles by Matter and the Structure of the Atom.” Philosophical Magazine, 1911.
6. Moseley, H. G. J. “The High-Frequency Spectra of the Elements.” Philosophical Magazine, 1913.
7. Soddy, F. “Intra-Atomic Charge.” Chemical News, Vol. 107, 1913.
8. Rutherford, E. “Collision of α Particles with Light Atoms: Hydrogen Emissions.” Philosophical Magazine, 1919.
9. Aston, F. W. Isotopes and Mass Spectra and Isotopes. London: Edward Arnold, 1922.
10. Chadwick, J. “The Existence of a Neutron.” Nature, 1932.
11. Einstein, A. “Does the Inertia of a Body Depend Upon Its Energy Content?” Annalen der Physik, 1905.
12. IUPAC and IUPAP. “Definition of the Unified Atomic Mass Unit (u).” Pure and Applied Chemistry, 1961.
13. IUPAC Commission on Isotopic Abundances and Atomic Weights. Atomic Weights of the Elements 2023 (Technical Report). IUPAC, 2023.
14. Audi, G., Wapstra, A. H., & Thibault, C. “The AME Atomic Mass Evaluation.” Nuclear Physics A, 2003.
15. NIST. Atomic Weights and Isotopic Compositions with Relative Atomic Masses. U.S. National Institute of Standards and Technology, 2023. https://physics.nist.gov
16. Atkins, P., & de Paula, J. Atkins’ Physical Chemistry. 12th ed., Oxford University Press, 2022.
17. Krane, K. S. Introductory Nuclear Physics. Wiley, 1987.
18. Scerri, E. R. The Periodic Table: Its Story and Its Significance. Oxford University Press, 2007.
19. Libby, W. F. The Atomic Theory and the Nature of Matter. University of Chicago Press, 1954.
20. Chemistry LibreTexts. “History of Atomic Mass and the Development of the amu.” https://chem.libretexts.org
21. OpenMedScience. “The Atomic Mass Unit and the Mass Defect.” https://openmedscience.com
22. ScienceDirect Topics. “Atomic Mass Unit (Overview).” https://www.sciencedirect.com
23. ThoughtCo. Helmenstine, A. M. “Definition of Atomic Mass Unit and Example.” https://www.thoughtco.com
24. Wikipedia. “Atomic Mass Unit.” (With its cited references, last accessed 2025.) https://en.wikipedia.org/wiki/Atomic_mass_unit
25. Royal Society of Chemistry (RSC). “The Discovery of the Neutron.” https://www.rsc.org
26. Britannica Online. “Isotopes, Mass Defect, and Binding Energy.” https://www.britannica.com
27. Nuclear Data Center (IAEA). “Mass Defect and Binding Energy Database.” https://www-nds.iaea.org