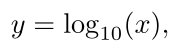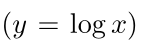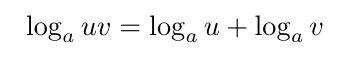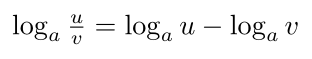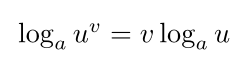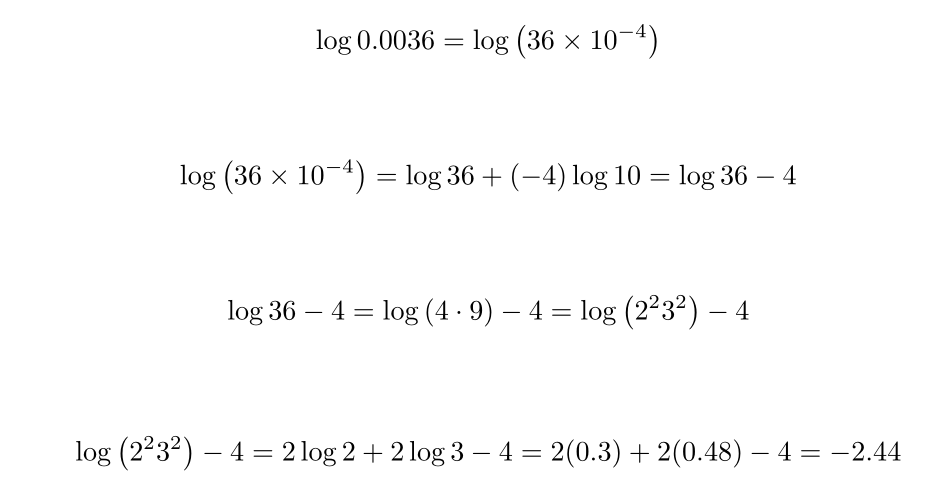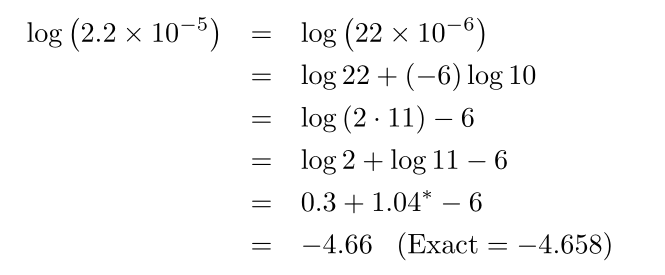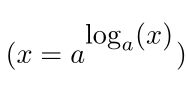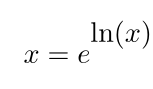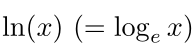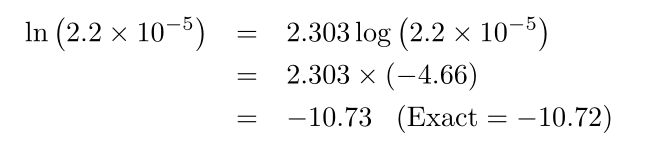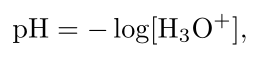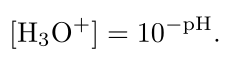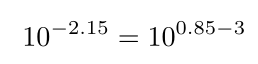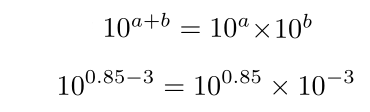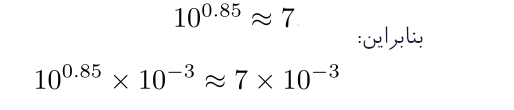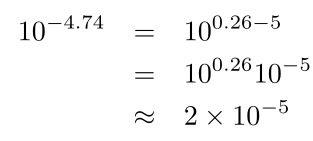شیمی ابرنواخترها
آذر 19, 1404
کشف بلوک های سازنده حیات در کیهان
دی 6, 1404آموزش لگاریتم برای دانشجویان شیمی
۱ لگاریتم
۱.۱ لگاریتم چیست؟
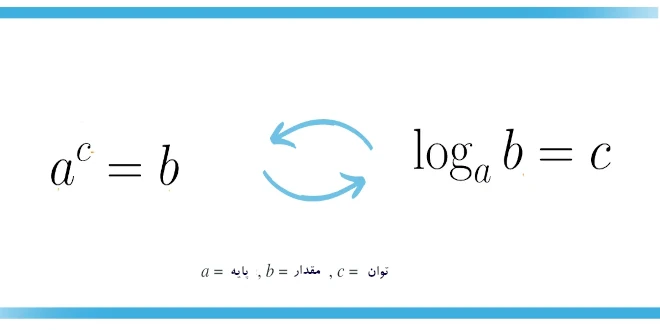
لگاریتمها تابع ریاضی هستند که برای نمایش عدد (y) که یک عدد صحیح پایه (a) به آن تبدیل میشود تا عدد x به دست آید، استفاده میشوند:
که در آن y = loga(x). اکثر شما با لگاریتم استاندارد پایه ۱۰ آشنا هستید:
که در آن:
لگاریتمی که پایه آن مشخص نشده باشد
همیشه به عنوان لگاریتم پایه ۱۰ در نظر گرفته میشود.
۱.۲ لگاریتمهای آسان
سادهترین لگاریتمها برای ارزیابی، که اکثر شما میتوانید با بررسی آنها را تعیین کنید، آنهایی هستند که در آنها y یک مقدار صحیح است. برای مثال، توانهای ده را در نظر بگیرید:
1.3 قوانین کار با لگاریتمها
چهار قانون جبری اصلی برای دستکاری لگاریتمها استفاده میشود:
قانون ۱: قانون حاصلضرب
قانون ۲: قانون خارج قسمت
قانون ۳: قانون توان
احتیاط!
رایجترین اشتباهات از دانشآموزانی ناشی میشود که به اشتباه از دو قانون کاملاً ساختگی استفاده میکنند (هیچ قانونی وجود ندارد که حتی شبیه اینها باشد):
![]()
همانطور که در فصلهای مربوط به ترمودینامیک، تعادل و سینتیک خواهیم دید، پیامد عملی این قوانین این است که ما قادر خواهیم بود عبارات جبری پیچیده را به راحتی ساده کنیم.
۱.۴ تقریب لگاریتمهای عددی
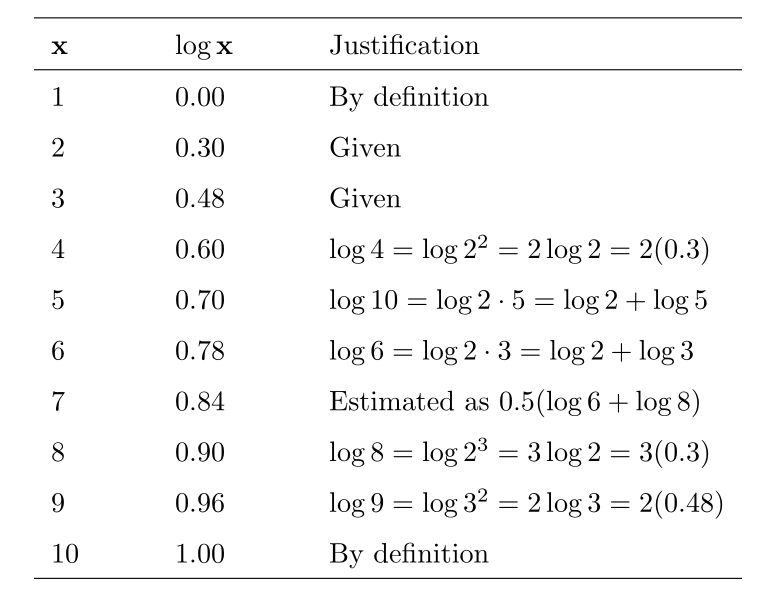
برای تقریب مقادیر عددی لگاریتمهای پایه ۱۰ غیربدیهی، به (الف) درک خوبی از قوانین کار با لگاریتمها و (ب) مقادیر log 2 و log 3 که به ترتیب 0.30 و 0.48 هستند، نیاز داریم. با استفاده از این مقادیر و قوانینی که در بالا آموختیم، میتوانیم به راحتی جدولی برای مقادیر لگاریتمی اعداد صحیح بین ۱ تا ۱۰ بسازیم:
لگاریتم اعداد 1 تا 10
توجه داشته باشید که log 7 با استفاده از تقریبی که نقطه میانی بین لگاریتم ۶ و لگاریتم ۸ است، تعیین شد.
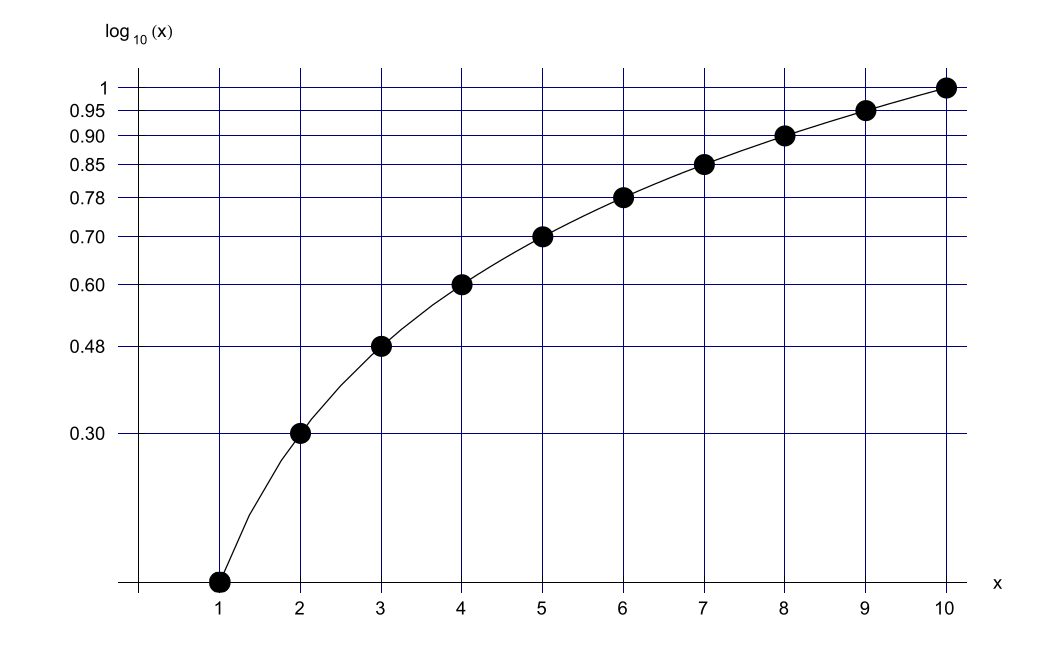
به طور کلی، با بزرگتر شدن اعداد، فاصله بین لگاریتمهای آنها کوچکتر میشود. در نتیجه، این رویکرد باید برای اعداد بزرگ به خوبی کار کند. نمایش گرافیکی این جدول به صورت زیر است:
همین رویکرد را میتوان برای اعداد بزرگتر از ده (یا کوچکتر از یک) نیز استفاده کرد. بیایید یک رویکرد کلی را هنگام حل لگاریتم 0.0036 شرح دهیم.
۱. اگر عدد اعشاری است، عدد را به صورت یک عدد صحیح ضربدر ۱۰ به توان بیان کنید.
۲. قوانین ضرب و توان را برای جدا کردن توان جمله ده و ارزیابی آن اعمال کنید.
۳. عدد باقی مانده (۳۶) را به عنوان حاصلضرب عوامل اول بیان کنید.
۴. قوانین ضرب و توان را برای جدا کردن همه عوامل اعمال کنید و از جدول برای log 1 تا log 10 استفاده کنید. ارزیابی کنید
همچنین مثال زیر را ببینید:
۱.۵ لگاریتمهای طبیعی
لگاریتمهای طبیعی زیرمجموعه خاصی از لگاریتم عمومی
هستند، که در آن پایه (a) عدد e (= ۲.۷۱۸ …) است. لگاریتم طبیعی به طور رسمی به صورت زیر تعریف میشود:
که در آن
«لگاریتم طبیعی x» است.
برای محاسبه لگاریتمهای طبیعی میتوانیم از اتحاد ساده زیر استفاده کنیم:
آنتیلگاریتمها
تابع آنتیلگاریتم یا توان، لگاریتم را به طور مؤثر خنثی میکند. بهترین مثال برای این مورد در شیمی، محاسبه غلظت یون هیدرونیوم از pH است. در این حالت،
این رابطه غلظت بسیار کوچک یون هیدروژن را به یک عدد ساده بین 0 تا 14 تبدیل میکند.
و همچنین غلظت یون هیدرونیوم را میتوان از pH با استفاده از فرمول زیر بدست آورد:
۲.۱ تقریب آنتیلگاریتمهای پایه ۱۰
آنتیلگاریتم عدد زیر را در نظر بگیرید.
روش محاسبه توان
به شرح زیر است:
۱. توان را به صورت ده به توان تفاضل دو عدد بازنویسی کنید: عددی بین ۰ و ۱ و یک عدد صحیح.
2. عبارات را با استفاده از اتحاد زیر از هم جدا کنید.
3. از تعریف لگاریتم پایه ده
برای تعیین مقدار x استفاده کنید. سادهترین راه برای انجام این کار استفاده از نمودار (یا جدول) لگاریتم از بخش 5.4 است. در این حالت
یک مثال دیگر:
در اینجا، از نمودار بخش ۱.۴ به صورت تقریبی برابر با ۲ محاسبه شده است.
کاربردهای اصلی لگاریتم در شیمی
1. محاسبه pH و pOH که در بالا شرح داده شد.
2. قانون بیر–لامبرت در طیفسنجی
رابطه:
قانون بیر-لامبرت بیان میکند که بخشی از نور پس از برخورد با شیشهٔ محلول رنگی، جذب و بخش دیگرش عبور میکند.
این کاربرد در شیمی نساجی و رنگها بسیار مهم است، چون شدت رنگ با غلظت رنگدانهها سنجیده میشود.
3. معادلات سرعت واکنشها
در واکنشهای مرتبه اول:
لگاریتم طبیعی (ln) کمک میکند تغییر غلظت با زمان به صورت خطی نمایش داده شود.
این روش برای تعیین ثابت سرعت (k) و نیمهعمر واکنشها استفاده میشود.
4. پتانسیل الکترودها (معادله نرنست)
رابطه:
لگاریتم در اینجا وابستگی پتانسیل الکترود به غلظت یونها را نشان میدهد.
کاربرد مهم در شیمی الکتروشیمیایی و باتریها.
5. ترمودینامیک و تعادل شیمیایی
ثابت تعادل KK اغلب در مقیاس لگاریتمی بررسی میشود:
این رابطه نشان میدهد که انرژی آزاد گیبس به صورت لگاریتمی با ثابت تعادل مرتبط است.
سرچشمه ها:
https://www.chem.purdue.edu/