نکات پیل الکتروشیمیایی
ویدیوهای کارگاه عملیات دستگاهی
دی ۷, ۱۴۰۰
دو آزمایش بر روی آب چغندر
بهمن ۷, ۱۴۰۰
در پیل:
– انرژی شیمیایی به انرژی الکتریکی تبدیل می شود.
– ولتاژ (نیرو محرکه یا نیروی الکتروموتوری) پیل همیشه مثبت است.
– واکنش پیل خود به خودی است.
-هر پیل دارای دو نیمه پیل است.
-هر نیمه پیل از یک تیغه ی فلزی در محلول نمک آن فلز تشکیل شده است.
-تیغه ی فلزی، الکترود و محلول، الکترولیت نامیده می شود.
-هر الکترود به عنوان هادی الکترونی است.
-الکترود های بسیاری از پیل ها علاوه بر هدایت الکترون در واکنش شیمیایی پیل نیز شرکت می کنند.
– الکترودی که پتانسیل کاهش کوچکتر دارد، آند(قطب منفی) است.
-آند در اثر حل شدن از وزنش کاسته می شود.
– الکترودی که پتانسیل کاهش بزرگتری دارد، کاتد(قطب مثبت) است.
-کاتد در اثر رسوبی که بر آن می نشیند وزنش افزایش می یابد.
-آند به دلیل آن که حل می شود، به تدریج از وزنش کاسته می شود.
– جهت حرکت الکترون از آند(قطب منفی) به کاتد(قطب مثبت) است.
– در آند(قطب منفی) عمل اکسایش و در کاتد(قطب مثبت) عمل کاهش صورت می گیرد.
– هر چه پتانسیل کاهش کوچکتر، تمایل عنصر برای دادن الکترون (اکسید شدن) بیشتر است.
– هر چه پتانسیل کاهش، بزرگتر تمایل برای گرفتن الکترون (کاهش) بیشتر است.
– هر چه فاصله دو فلز الکترود در سری الکترو شیمیایی بیشتر باشد، ولتاژ پیل بیشتر است.
– نقش پل نمکی، تکمیل مدار و مهاجرت یون ها می باشد.
– پل نمکی باید حاوی محلول نمکی باشد که با هیچ یک از الکترولیت ها واکنش ندهد.
مثل آمونیم کلرید، پتاسیم کلرید، پتاسیم یا آمونیم نیترات
– در پل نمکی کاتیون ها، به سمت کاتد و آنیون ها، به سمت آند می روند.
سری الکترو شیمیایی:
یک سری از عناصر شیمیایی که بر اساس پتانسیل الکترودی کاهش مرتب شده اند. الکترود هیدروژن، پتانسیل الکترودی صفر در نظر گرفته می شود. عناصری که نسبت به هیدروژن تمایل بیشتری به دادن الکترون دارند، الکتروپوزتیو خوانده می شوند و در بالای هیدروژن قرار می گیرند و پتانسیل کاهش منفی دارند و عناصری که الکترون می گیرند، زیر هیدروژن در این سری قرار گرفته و عناصر الکترونگاتیو نامیده می شوند و پتانسیل کاهش مثبت دارند.
فلزات الکتروپوزتیو ، آنهایی که بالای هیدروژن قرار دارند و پتانسیل کاهش منفی دارند جانشین هیدروژن اسید ها می شوند و نمک و هیدروژن تولید می کنند.
ویژگی های الکترود استاندارد هیدروژن:
به راحتی ساخته می شود.
واکنش آن برگشت پذیر است.
تکرار پذیری زیادی در رفتارش وجود دارد.
الکترود گازی است.
رسانای آن یک قطعه پلاتین است که در محلول یک مولار هیدروکلریک اسید فرو رفته است.
گاز هیدروژن با فشار یک اتمسفر بر روی آن دمیده می شود.
پلاتین در واکنش شرکت نمی کند و فقط الکترون ها را منتقل می کند.
واکنش این نیمه پیل، نیمه واکنش زیر است:
2H+ + 2e– ⇌ H2
محاسبه نیروی محرکه پیل: اختلاف پتانسیل موجود میان الکترودهای یک پیل را نیروی الکتروموتوری یا نیروی محرکه پیل می گویند که از فرمول زیر محاسبه می شود:
E0 =E0cathode – E0anode
برای محاسبه ی ولتاژ یک پیل: الکترودی که پتانسیل کاهش بزرگ تری دارد، کاتد و الکترودی که پتانسیل کاهش کوچک تری دارد، آند در نظر گرفته شده است. اعداد را در فرمول بالا قرار داده ولتاژ پیل را حساب کنید.
اختلاف پتانسیل میان دو الکترود در واحد ولت اندازه گیری می شود و نیروی محرکه پیل نامیده می شود.
به خاطر داشته باشید ولتاژ یک پیل همیشه مثبت است.
پیشگویی خود به خودی بودن یا نبودن یک واکنش: برای پیشگویی خود به خودی بودن یا نبودن یک واکنش نیز باید از فرمول بالا استفاده کنید ولی برای پیدا کردن آند و کاتد نباید به پتانسیل کاهش ها نگاه کنید، بلکه باید به معادله واکنش نگاه کنید. عنصری که الکترون از دست داده و اکسید شده، آند و عنصری که الکترون گرفته و کاهش یافته، کاتد می باشد و بر این اساس نیرو محرکه را حساب کنید. اگر نیرو محرکه مثبت شد واکنش خود به خودی (پیل) و اگر نیرو محرکه منفی شود واکنش غیر خود به خودی (الکترولیز) می باشد.
بیشتر بدانید:
در شیمی عمومی آموختیم به طور کلی فلزات دوست دارند الکترون از دست بدهند و نا فلزات دوست دارند الکترون بگیرند. اما تمایل همه ی فلزات برای از دست دادن الکترون یکسان نیست(همان طور که تمایل همه ی نافلزات برای از گرفتن الکترون یکسان نیست). برخی از فلزات مانند فلزات قلیایی تمایل بسیار زیادی برای از دست دادن الکترون دارند و برخی از فلزات مانند فلزات نجیب(طلا، پلاتین….) تمایلی به دادن الکترون ندارند(به همین دلیل در طبیعت به صورت خالص یافت می شوند).
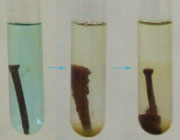
در یک آزمایش اگر یک میخ آهنی را در محلول مس سولفات قرار دهیم پس از مدتی فلز قرمز رنگ مس بر روی آهن رسوب می کند و محلول آبی رنگ مس سولفات به رنگ قهوه ای آهن(II) سولفات بر می گردد، یعنی واکنش زیر اتفاق می افتد.
Fe + CuSO4 → FeSO4 + Cu
در واکنش بالا آهن به یون مس الکترون داده، آهن اکسید و یون مس کاهش یافته
یعنی:
Fe + Cu2+ → Fe2+ + Cu
اکنون اگر عکس آزمایش بالا را انجام دهیم یعنی یک تیغه ی مسی را در محلول آهن(II) سولفات قرار دهیم، واکنش انجام نمی شود.
Cu + FeSO4 → CuSO4 + Fe
یا
Cu + Fe2+ → Cu2+ + Fe
واکنش بالا خودبه خودی نیست. یعنی مس به یون آهن خود به خود الکترون نمی دهد
از دو آزمایش بالا به این نتیجه می رسیم که تمایل آهن برای دادن الکترون بیش از مس است چون آهن به یون مس الکترون داد ولی مس به یون آهن الکترون نداد.
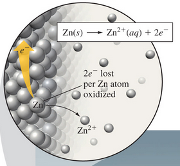
خب اکنون اگر فلزی مانند روی که تمایل به دادن الکترون دارد را درون محلول نمک همان فلز (روی سولفات) قرار دهیم. فلز روی الکترون از دست داده در محلول حل می شود(اکسید می شود) اما چون تیغه از بار منفی (حاصل از آزاد شدن الکترون) و محلول از بار مثبت(حاصل از آزاد شدن کاتیون روی) اشباع می شود واکنش به تعادل می رسد.
اگر در بشر دیگری تیغه ی فلزی مانند مس که تمایل به گرفتن الکترون دارد را درون محلول نمک آن (مس سولفات) قرار دهیم. فلز مس به یون مس (موجود در محلول) الکترون داده یون مس را کاهش می دهد. اما چون تیغه از الکترون خالی می شود(از بار مثبت اشباع می شود) و چون یون مس به مس فلزی تبدیل می شود غلظت آنیون سولفات نسبت به یون مس بیشتر شده محلول از بار منفی اشباع شده واکنش به تعادل می رسد.
Cu2+ + 2e– ⇌ Cu
اکنون اگر دو الکترود را با یک سیم (که در مسیر آن یک ولتمتر است)به هم وصل کنیم الکترون ها از تیغه ی روی به مس می روند و یک لحظه جریان برقرار می شود. ولی زود جریان قطع می شود چون محلول روی سولفات از بار مثبت و محلول مس سولفات از بار منفی اشباع است.
اگر بین دو بشر یک لوله U شکل پر از محلول نمکی که با هیچ یک از الکترولیت ها واکنش ندهد(مثل آمونیم نیترات، پتاسیم نیترات….) مرتبط کنیم جریان برق به طور مداوم برقرار می شود. به این لوله U شکل پل نمکی می گویند. پل نمکی را با خیساندن یک نوار چند لایه از کاغذ صافی در محلول نمک هم می توان درست کرد.
در پل نمکی، کاتیون ها به سمت کاتد و آنیون ها به سمت آند می رود.
واکنش کلی این پیل از جمع دو نیمه واکنش بالا به دست می آید.
Zn → Zn2+ + 2e–
Cu2+ + 2e– → Cu
………………….
Zn + Cu2+ → Cu + Zn2+
در سه واکنش بالا واکنش اول، واکنش آندی(اکسایش)، قطب منفی
واکنش دوم، واکنش کاتدی(کاهش)، قطب مثبت
و واکنش سوم واکنش کلی پیل است
سرچشمه عکس هدر:
https://glossary.periodni.com/glossary.php?en=electrochemical+cell